الرابطة الأيونية Ionic Bond
(الكيمياء العامة المستوى الاول – الكلية الجامعية بالجموم)
ما هي الرابطة الأيونية Ionic Bond ؟
- تعرف ايضا باسم رابطة إلكتروتكافؤية أو الكهروتكافؤية electrovalent bond ، و هو نوع من الروابط ينتج عن التجاذب الكهروستاتيكي بين الايونات المخالفة لبعضها البعض في الشحنة في المركب الكيميائي . تنشأ هذه الرابطة عندما تنتقل إلكترونات التكافؤ نهائيا من ذرة ما إلى ذرة أخرى . فالذرات التي تفقد إلكتروناتها تصبح ايونات موجبة (كاتيونات) بينما الذرات التي تكتسب الإلكترونات تصبح أيونات سالبة (انيونات) . توجد الروابط الأيونية في المركبات التي تعرف باسم مركبات أيونية او إلكتروتكافؤية و التي يمكن تبسيطها من خلال المركبات التي تنتج عن تفاعل اللافلزات مع الفلزات القلوية أو القلوية الترابية , و في مثل تلك المركبات تكون كل أيون موجب محاطا بأيونات سالبة و كذلك كل أيون سالب يكون محاطا بأيونات موجبة .
- تتكون الرابطة الأيونية من ثلاث خطوات: 1 – يفقد المعدن (الفلز) النشط الإلكترون الأكثر بعداً عن النواة، ويصبح موجب الشحنة. 2 – يكتسب اللامعدن (اللافلز) هذا الإلكترون، ويصبح سالب الشحنة. 3 – يحدث تجاذب كهروستاتيكي بين الأيون الموجب والسالب.

- يشترط لتكوين الرابطة الأيونية الشروط الآتية:
1 – أن يوجد فلز نشط قابل لفقد إلكترون أو أكثر بأقل قدر من الطاقة أي صغر جهد تأين ذرة المعدن (الفلز) ، و العناصر التي ينطبق عليها الشرط الأول هي المجموعة الأولى والثانية وهي العناصر القلوية والعناصر القلوية الأرضية على التوالي.
2 – أن يوجد لا فلز نشط قابل لاكتساب إلكترون أو أكثر دون الحاجة إلى طاقة تذكر أي كبر الألفة الإلكترونية للامعدن (اللافلز)، و العناصر التي ينطبق عليها الشرط الثاني فهي عناصر المجموعة السابعة عشر والسادسة عشر.
3 – كبر طاقة الترابط البلوري وطاقة التجاذب الكهروستاتيكي بين الأيونات.
- طاقة تأين الفلزات منخفضة مما يجعلها تميل إلى فقد الإلكترونات و تكوين أيونات موجبة.
- تتميز اللافلزات بارتفاع الألفة الكهربائية و بالتالي شغفها لكسب الإلكترونات و تكوين أيونات سالبة.
- عند اقتراب ذرة اللافلز من ذرة فلز فإنها تميل إلى جذب إلكترونات تكافؤ ذرة الفلز فيتكون الأيونان الموجب و السالب و نتيجة لذلك يحدث تجاذب كهربائي بينهما يؤدي إلى انطلاق كمية كبيرة من الطاقة بسبب هذا التجاذب فتنخفض طاقة المركب الناتج.
- تعرف الطاقة الناتجة عن تجاذب الأيونات السالبة و الموجبة باسم طاقة الشبكة البلورية و تعرف بأنها مقدار الطاقة الناتجة من تجاذب الأيونات الموجبة و السالبة لتكوين مول واحد من بلورات المادة الصلبة.
- يمكن أن تنشأ الرابطة الأيونية بين المجموعات الذرية كمجموعة النترات السالبة ‒NO3 مع أيون مجموعة موجبة مثل مجموعة الأمونيوم .
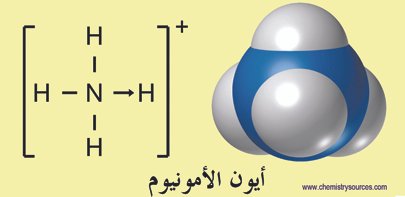
أمثلة على الروابط الأيونية
- يتفاعل عنصر الكلور مع عنصر الصوديوم لتتكون المادة المركبة كلوريد الصوديوم (ملح الصوديوم).
- العدد الذري للصوديوم (11) لذلك يكون تركيبها الإلكتروني (2,8,1).
- العدد الذري للكلور (17) ولذلك يكون التركيب الإلكتروني (2,8,7).
- ينتقل إلكترون واحد من المدار الخارجي لذرة الصوديوم إلى المدار الخارجي لذرة الكلور وبذلك يتكون أيون الكلوريد الذي يشابه تركيبه الإلكتروني للنيون.
- يحمل أيون الكلور شحنة كهربية سالبة لأن عدد الإلكترون الموجودة في المدارات أصبح ثـمانية عشر (18) بينما عدد البروتونات في النواة (17).
- يحمل أيون الصوديوم شحنة كهربية موجبة لأن عدد الإلكترونات في المدارات (10). بينما عدد البروتونات في النواة لم يتغير (11).
- تنشأ بين هذين الأيونين قوة تجاذب إلكتروستاتيكية تجعلهما متصلين مع بعضهما البعض.
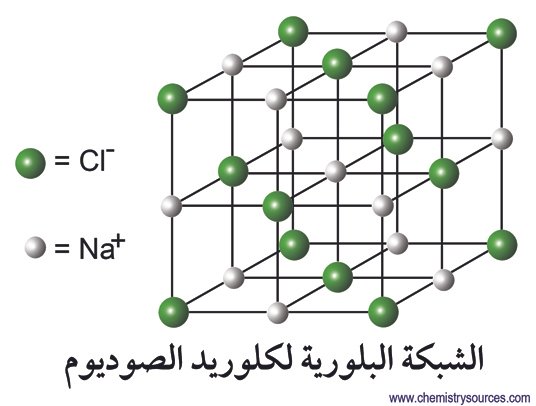

- تتكون المركبات الأيونية عندما تتفاعل الذرات الكهروموجبة القوية مع المركبات الكهروسالبة القوية مع بعضها البعض.
- تتماسك الأيونات في بلورة المادة الأيونية مع بعضها البعض من خلال قوى التجاذب بين الشحنات المخالفة بالشحنة.
- الرابطة الأيونية ليست رابطة بالمعنى الحقيقي على الإطلاق حيث أنة الأيونات تجذب بعضها البعض كما تجذب أقطاب المغناطيس بعضها البعض.
- عندما يتم تذويب المادة الأيونية في الماء، فإن الأيونات تنفصل عن بعضها البعض و يكون لديها القدرة على التحرك في المحلول بحرية.
الخصائص العامة للمركبات الأيونية
- تتميز المركبات الأيونية بالآتي:
1 – تتميز عن غيرها من المواد الصلبة بأنها هشة، غير قابلة للطرق والسحب، وتعود هشاشة هذه المواد إلى أن أي محاولة لضغط البلورات يؤدي إلى تنافر شديد فتتحطم البلورة.
2 – تتميز مصهوراتها ومحاليلها بالتوصيل الجيد للتيار الكهربائي، بسبب التفكك إلى الأيونات الموجبة والسالبة، وهذه الأيونات تقوم بالتوصيل الكهربائي.
3 – تتميز بدرجات انصهار وغليان عالية، ويعود السبب لزيادة قوى التجاذب بين الأيونات الموجبة والسالبة والتي تعمل كأقطاب مزدوجة لها عزم معين ينتج عنه تقارب الأيونات.
4 – لا تذوب في المذيبات العضوية، وإنما تذوب في المذيبات القطبية مثل الماء، ويعود السبب في ذوبان المواد الأيونية في المذيبات القطبية إلى تكون نوع من الارتباط بين الأيون وجزيئات المذيب القطبية.
5 – سريعة التفاعل وتامة، لأن التفاعل يحصل بمجرد التصادم بين الأيونات.
لتحميل لوحة عن الرابطة الأيونية إضغط على الرابط الآتي: لوحة (بوستر) الرابطة الأيونية Ionic Bonding
بوسترات (لوحات) كيميائية بدقة عالية (أكثر من 25 لوحة) من تصميم الأستاذ أكرم أمير العلي
تطبيقات كيميائية من تصميم الأستاذ أكرم امير العلي متوفر للجوالات التي تعمل بنظام أندرويد android على سوق جوجل بلاي google play
1 – تطبيق ملصقات الجدول الدوري باللغة العربية : بطاقات تحتوي على معلومات شاملة و مختصرة في نفس الوقت كل عنصر على حدة (اللغة العربية).
https://play.google.com/store/apps/details?id=com.akramir2
2 – تطبيق ملصقات كيميائية: ملصقات بتصميم جميل جدا للكواشف و الأدلة و الزجاجيات المستخدمة في المختبر و كذلك ملصقات و بطاقات لخزانات حفظ المواد و الأدوات الزجاجية .
https://play.google.com/store/apps/details?id=com.akramir
3 – إذا كنت تواجه صعوبة في تحضير المحاليل الكيميائية الأكثر شيوعا في مختبرات الكيمياء و الاحياء، فهذا التطبيق سوف يساعدك كثيرا في تحضير المحاليل :
مقالات قد تفيدك :
 مصادر الكيمياء موقع لتعليم الكيمياء بصورة مبسطة
مصادر الكيمياء موقع لتعليم الكيمياء بصورة مبسطة
جزاكم الله خيرا
شكرا لمروركم الكريم. أرجو الاطلاع على المقال التالي:
https://chemistrysources.com/2018/11/%d9%84%d9%88%d8%ad%d8%a9-%d8%a8%d9%88%d8%b3%d8%aa%d8%b1-%d8%a7%d9%84%d8%b1%d8%a7%d8%a8%d8%b7%d8%a9-%d8%a7%d9%84%d8%a3%d9%8a%d9%88%d9%86%d9%8a%d8%a9-ionic-bonding/