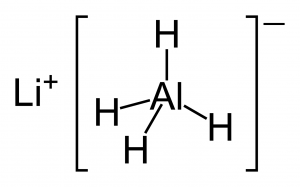
 هيدريد الألومنيوم الليثيوم (هيدريد ألومنيوم الليثيوم) Lithium Aluminium Hydride :
هيدريد الألومنيوم الليثيوم (هيدريد ألومنيوم الليثيوم) Lithium Aluminium Hydride :
يتم الإشارة إليه بالاختصار LAH و يعرف أيضا باسم رباعي هيدرو ألومينات الليثيوم lithium aluminiumtetrahydride و هو مركب غير عضوي و صيغته الكيميائية LiAlH4. وزنه الجزيئي 37.95 جرام/مول، كثافته 0.917 جرام/سم3 . هذا المركب مستقر في الهواء الجاف فقط عند درجة حرارة الغرفة ، و يتفكك عند درجة حرارة 125 درجة سيليزية ، و عند درجة حرارة 120 سيليزية يتفكك في الهواء الرطب ، كما أنه قابل للأحتراق عند طحنه بوجود الهواء . يتفاعل بسرعة مع الماء و الكحولات ، كما يعمل على اختزال الألدهيدات و الكيتونات و الحموض الكلوريدية و الأسترات إلى كحولات و النيتريلات تختزل الى امينات و مركبات النيترو العطرية إلى مركبات آزو . يمكن تحضير هذه المادة من خلال تفاعل هيدريد الليثيوم مع كلوريد الألومنيوم .
يجب حفظ هذه المادة بعيدا عن مصادر النيران و ان تحفظ في مكان جاف و بارد .
تم اكتشافه من قبل Finholt، Bond and Schlesinger في العام 1947.و يستخدم هذا المركب كعامل مختزل في التحضيرات العضوية و خاصة لاختزال الأسترات و الحموض الكربوكسيلية والأميدات. فالمادة الصلبة منه نشطة جدا و بشكل خطير تجاه الماء ، حيث يتنتج التفاعل مع الماء الهيدروجين الغازي (H2).
و هيدريد الألومنيوم الليثيوم مادة صلبة عديمة اللون أو بيضاء اللون ، ولكن العينات التجارية منها عادة ما تكون رمادية بسبب التلوث. و يمكن تنقية هذه المادة من الشوائب عن طريق إعادة بلورة من خلال إيثيل الإيثر. أما للتنقية على نطاق واسع فإنه يجأ إلى الاستخلاص من خلال جهاز سوكسلت Soxhlet . و عادة ما يتم استخدام المادة الرمادية ذات الشوائب في التحضيرات المختلفة ، حيث أن الشوائب غير ضارة ويمكن فصلها بسهولة عن المنتجات العضوية.
أما المواد النقية و التي توجد على شكل مسحوق فإنها قابلة للاشتعال تلقائيا في حال تعرضها للهواء ، و لكن بلوراتها ليست كبيرة و تحتوي بعض المواد التجارية على زيوت معدنية لتثبيط التفاعلات مع الرطوبة في الغلاف الجوي لضمان عدم اشتعالها التلقائي ولكن الأكثر شيوعًا أنها تكون معبأة في أكياس بلاستيكية مقاومة للرطوبة.
يتفاعل هيدريد الألومنيوم الليثيوم بعنف مع الماء ، بما في ذلك الرطوبة في الغلاف الجوي. و يحدث التفاعل وفقًا للمعادلة المثالية التالية:
LiAlH4 + 4H2O → LiOH + Al(OH)3 + 4H2
و هذا التفاعل يعتبر طريقة مفيدة لتوليد الهيدروجين في المختبر. غالبًا ما تظهر العينات القديمة مه والمكشوفة للهواء باللون الأبيض لأنها امتصت ما يكفي من الرطوبة لتوليد مزيج من المركبات البيضاء هيدروكسيد الليثيوم وهيدروكسيد الألومنيوم.
و يتم تحضير هيدريد الألومنيوم الليثيوم أولاً من التفاعل بين هيدريد الليثيوم (LiH) وكلوريد الألومنيوم:
4LiH + AlCl3 → LiAlH4 + 3LiCl
بالإضافة إلى هذه الطريقة ، يستلزم التركيب الصناعي التحضير الأولي لهيدريد الألومنيوم الصوديوم من العناصر تحت الضغط العالي ودرجة الحرارة:
Na + Al + 2H2 → NaAlH4
بعد ذلك ، يتم تحضير هيدريد الألومنيوم الليثيوم بواسطة تفاعل تبادلي وفقاً لما يلي:
NaAlH4 + LiCl → LiAlH4 + NaCl
و تتم إزالة LiCl عن طريق الترشيح من محلول أثيري من LiAH ، مع الترسيب اللاحق لل LiAlH4 لإنتاج منتج يحتوي على حوالي 1 ٪ وزن / وزن LiCl.
و هناك طريقة أخرة لانتاج هيدريد الألومنيوم الليثيوم تبدأ من LiH و فلز Al بدلاً من AlCl3. يتم تحفيز التفاعل باستخدام كمية صغيرة من ثلاثي كلوريد التيتانيوم TiCl3 بتركيز (0.2٪) ، ويتم ذلك باستخدام ثنائي ميثيل إيثر dimethylether كمذيب.
وهيدريد الألومنيوم الليثيوم قابل للذوبان في العديد من المحاليل الأثيرية. ومع ذلك ، قد يتحلل تلقائيًا بسبب وجود شوائب حفازة ، و على الرغم من أنه يبدو أكثر ثباتًا في رباعي هيدروفيوران (THF). وبالتالي إلا أنه يُفضل استخدام رباعي هيدروفيوران THF .
و يستخدم هيدريد الألومنيوم الليثيوم على نطاق واسع في الكيمياء العضوية كعامل مختزل. وهو أقوى من كاشف البوروهيدريد الصوديوم بسبب ضعف رابطة Al-H مقارنة برابطة B-H.و نظرًا لطبيعة هيدريد الألومنيوم الليثيوم الحرارية ، وعدم الاستقرار ، والسمية ، والعمر الافتراضي المنخفض ، والتعامل مع المشكلات المرتبطة بفاعليته ، فقد تم استبداله في العقد الماضي ، سواء على نطاق الصناعة الصغيرة أو كمادة مختزلة واسعة النطاق.
بوسترات (لوحات) كيميائية بدقة عالية (أكثر من 25 لوحة) من تصميم الأستاذ أكرم أمير العلي
تطبيقات كيميائية من تصميم الأستاذ أكرم امير العلي متوفر للجوالات التي تعمل بنظام أندرويد android على سوق جوجل بلاي google play
1 – تطبيق ملصقات الجدول الدوري باللغة العربية : بطاقات تحتوي على معلومات شاملة و مختصرة في نفس الوقت كل عنصر على حدة (اللغة العربية).
https://play.google.com/store/apps/details?id=com.akramir2
2 – تطبيق ملصقات كيميائية: ملصقات بتصميم جميل جدا للكواشف و الأدلة و الزجاجيات المستخدمة في المختبر و كذلك ملصقات و بطاقات لخزانات حفظ المواد و الأدوات الزجاجية .
https://play.google.com/store/apps/details?id=com.akramir
3 – إذا كنت تواجه صعوبة في تحضير المحاليل الكيميائية الأكثر شيوعا في مختبرات الكيمياء و الاحياء، فهذا التطبيق سوف يساعدك كثيرا في تحضير المحاليل :
مقالات قد تفيدك :
 مصادر الكيمياء موقع لتعليم الكيمياء بصورة مبسطة
مصادر الكيمياء موقع لتعليم الكيمياء بصورة مبسطة