حمض البكريك Picric Acid : يعرف ايضا باسم 6،4،2-ثلاثي نيترو فينول trinitrophenol و هو مركب صلب بلوري اصفر اللون عديم الرائحة يستخدم كمادة صابغة و كمادة متفجرة ايضا و كذلك كمادة مطهرة . و نظرا لخطورته فإن التعامل معه بعنف 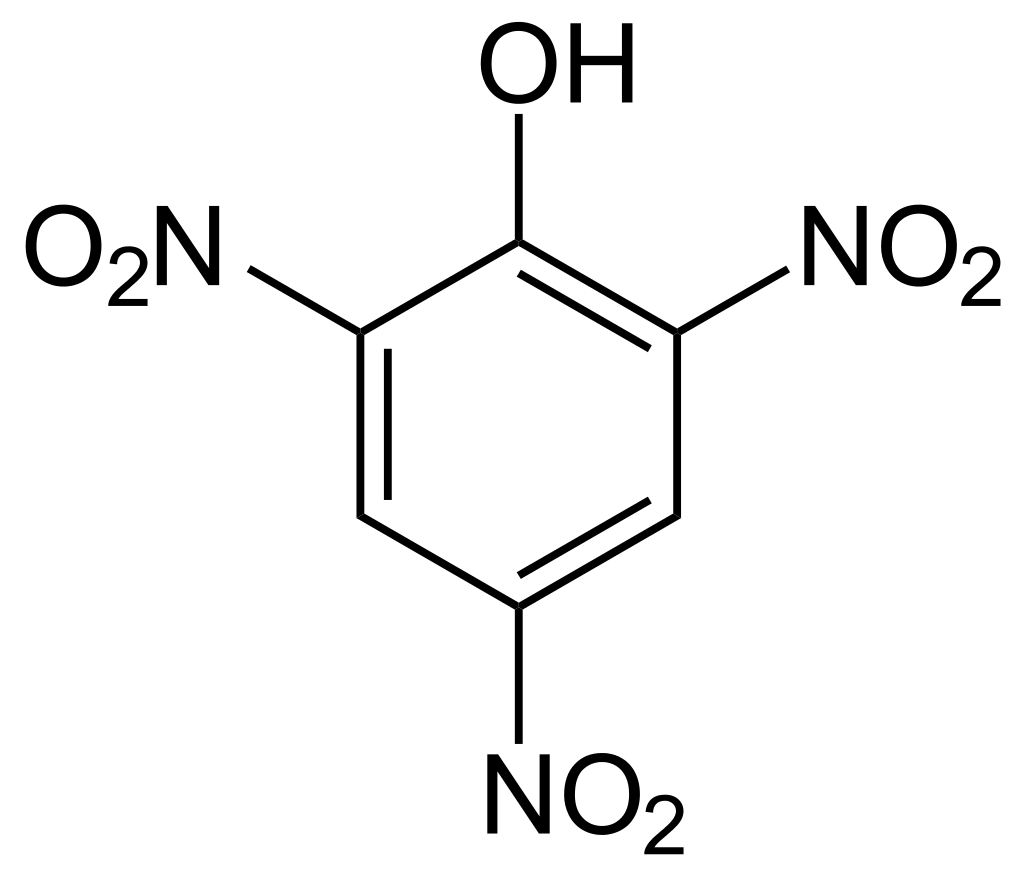 او تسخينه السريع قد يؤدي إلى انفجاره ، حيث انه قابل للإنفجار عند درجة حرارة اعلى من 300 درجة سيليزية . الصيغة الكيميائية لحمض البكريك هي C6H3N3O7 و وزنه الجزيئي 229.11 جرام/مول، و كثافته 1.763 جرام/سم3 ، و درجة انصهاره 121 درجة سيليزية .
او تسخينه السريع قد يؤدي إلى انفجاره ، حيث انه قابل للإنفجار عند درجة حرارة اعلى من 300 درجة سيليزية . الصيغة الكيميائية لحمض البكريك هي C6H3N3O7 و وزنه الجزيئي 229.11 جرام/مول، و كثافته 1.763 جرام/سم3 ، و درجة انصهاره 121 درجة سيليزية .
و حمض البكريك قابل للذوبان في الماء و الكحول و البنزين و الكلوروفورم ، وهو أيضا أقوى من الفينول فهو يفكك الكربونات و يمكن بالتالي معايرته مع القواعد . يجب حفظه في مكان بارد و بعيدا عن الحرارة .
يتم تنشيط الحلقة العطرية من الفينول بشكل كبير تجاه تفاعلات الاستبدال الإلكتروفيلي (المحب للإلكترون) و العمل على نترتة الفينول حتى مع حمض النتريك المخفف فيؤدي ذلك إلى تكوين قطران ذو وزن جزيئي عال. و من أجل تقليل هذه التفاعلات الجانبية ، يتم كبرتة الفينول اللامائي بحمض الكبريتيك المدخن ، وبعد ذلك يتم نترتة حمض بارا هيدروكسي فينيل السلفونيك p-hydroxyphenylsulfonic الناتج بحمض النيتريك المركز. و خلال هذا التفاعل ، يتم إدخال مجموعات النيترو ، و طرد مجموعة حمض السلفونيك. و هذا التفاعل طارد للحرارة للغاية ، والتحكم الدقيق في درجة الحرارة مطلوب. و هناك طريق آخر لصنع حمض البكريك وهو النترة المباشرة لـ 2،4-ثنائي نيتروفينول مع حمض النتريك.
الإستخلاص و طرق تحضير حمض البكريك Picric Acid
تم استخلاص حمض البكريك عام 1771 من قبل الكيميائي الإنجليزي بيتير وولف من خلال معالجة الإنديجو بحمض النيتريك و قد كان يستعمل كصباغ أصفر لصبغ الحرير في بداية الأمر منذ بدايات 1849 . كما يمكن تحضيره من خلال كبرتتة الفينول و من ثم معالجته بحمض النيتريك ، أو من خلال معالجة البنزين بحمض النيتريك و نترات الزئبق II .
إستخدامات حمض البكريك Picric Acid
إلى حد بعيد ، كان الاستخدام الأكبر لحمض البكريك في الذخائر والمتفجرات وخصوصا المتفجر D كما وجد لحمض البكريك استخداماته في الكيمياء العضوية لتحضيرالأملاح البلورية من القواعد العضوية (picrates) لغرض تحديد وتوصيف.
في علم المعادن ، يستخدم حمض البكريك بنسبة 4٪ في لصناعة مادة للحفر على الصخور و المعادن تعرف باسم “picral” و تستخدم بشكل شائع في علم دراسة المعادن الضوئية للكشف عن حدود الحبوب الأوستينية السابقة في الفولاذ الحديدي. و نظرا للمخاطر المرتبطة بحمض البكريك فقد تم استبداله إلى حد كبير بمواد كيميائية أخرى. ومع ذلك ، لا يزال يستخدم لحفر سبائك المغنيسيوم ، مثل AZ31.
كما يستخدم حمض البكريك في مختبر الكيمياء السريرية في تفاعل جافي لاختبار الكرياتينين.
و تنصح احتياطات السلامة الحديثة بتخزين حمض البريك الرطب لتقليل خطر الانفجار. فحمض البكريك الجاف حساس نسبيًا للصدمة والاحتكاك ، لذا المختبرات التي تستخدمه تخزنه في زجاجات تحت طبقة من الماء ، مما يجعله آمنًا. وحمض البكريك يمكنه بسهولة تشكيل أملاح بيكاترات معدنية أكثر حساسية وخطورة من الحمض نفسه. و من الناحية الصناعية ، يعتبر حمض البكريك خطيرًا بشكل خاص لأنه متقلب حتى في درجة حرارة الغرفة. بمرور الوقت ، يمكن أن يشكل تراكم البكرات picrate على الأسطح المعدنية المكشوفة خطر الانفجار. و غالبًا ما يتم استدعاء وحدات التخلص من المواد الكيميائية للتخلص من حمض البكريك إذا جفت.
بوسترات (لوحات) كيميائية بدقة عالية (أكثر من 25 لوحة) من تصميم الأستاذ أكرم أمير العلي
تطبيقات كيميائية من تصميم الأستاذ أكرم امير العلي متوفر للجوالات التي تعمل بنظام أندرويد android على سوق جوجل بلاي google play
1 – تطبيق ملصقات الجدول الدوري باللغة العربية : بطاقات تحتوي على معلومات شاملة و مختصرة في نفس الوقت كل عنصر على حدة (اللغة العربية).
https://play.google.com/store/apps/details?id=com.akramir2
2 – تطبيق ملصقات كيميائية: ملصقات بتصميم جميل جدا للكواشف و الأدلة و الزجاجيات المستخدمة في المختبر و كذلك ملصقات و بطاقات لخزانات حفظ المواد و الأدوات الزجاجية .
https://play.google.com/store/apps/details?id=com.akramir
3 – إذا كنت تواجه صعوبة في تحضير المحاليل الكيميائية الأكثر شيوعا في مختبرات الكيمياء و الاحياء، فهذا التطبيق سوف يساعدك كثيرا في تحضير المحاليل :
مقالات قد تفيدك :
 مصادر الكيمياء موقع لتعليم الكيمياء بصورة مبسطة
مصادر الكيمياء موقع لتعليم الكيمياء بصورة مبسطة