ملخص الفصل العاشر : الغازات Gases
من كتاب : CHEMISTRY THE CENTRAL SCIENCE حسب مقرر 103 كيمياء جامعة العلوم التطبيقية
1.10 | خصائص الغازات CHARACTERISTICS OF GASES
- تختلف العديد من المواد الغازية من حيث الخصائص الكيميائية و لكن لديها تقارب إلى حد ما من حيث الخصاص الفيزيائية ، فمثلا لكلا من الاكسجين O2 و النيتروجين N2 خصائص كيميائية مختلفة، و لكم من حيث الخصائص الفيزيائية فهما يسلكان نفس السلوك إلى حد ما بسبب كون خصائصها الفيزيائية إلى حد ما متطابقة.
- من بين العناصر القليلة الموجودة كغازات عند درجات حرارة وضغوط العادية : الهيليوم He والنيون Ne و الأرجون Ar و الكريبتون Kr و الزينون Xe و هي غازات أحادية الذرة و الهيدروجين H2 والنيتروجين N2 و الأكسجين O2 و الفلور F2 و الكلور Cl2 و هي غازات ثنائية الذرة.
- كل هذه الغازات هي عناصر لا فلزية. علاوة على ذلك، فإن لديها صيغ جزيئية بسيطة ، وبالتالي كتل مولارية منخفضة.
- المواد التي تكون سائلة أو صلبة في ظل الظروف العادية يمكن أن توجد أيضًا في الحالة الغازية، حيث يشار إليها غالبًا على أنها أبخرة. فمثلا يمكن أن توجد مادة H2O ، على سبيل المثال، في صورة ماء سائل أو ثلج صلب أو بخار ماء
- تختلف الغازات عن المواد الصلبة والسوائل لأن جزيئات الغازات متباعدة نسبيًا. وبالتالي:
– يمكن للغازات أن تتمد تلقائيًا لملء الحاوية التي تحتويها.
– يمكن أن تنضغط بسهولة عندما يطبق ضغط عليها.
– يمكن أن تشكل خليطًا متجانسًا بغض النظر عن كينونتها أو النسب النسبية للغازات.
- تختلف الغازات عن المواد الصلبة والسوائل لأن جزيئات الغازات متباعدة نسبيًا. وبالتالي:
- يتصرف كل جزيء غاز بشكل كبير كما لو لم يكن هناك أي غازات أخرى. نتيجة لذلك ، تتصرف الغازات المختلفة بشكل مشابه على الرغم من أنها تتكون من جزيئات مختلفة.
2.10 | الضغط PRESSURE
- يعرف الضغط P في العلوم بأنها مقدار القوة التى تؤثر على المساحة A

الضغط الجوي و البارومتر
Atmospheric Pressure and the Barometer
- تتسبب قوى الجاذبية في ضغط الغلاف الجوي ككل لأسفل على سطح الأرض ، مما يؤدي إلى حدوث ضغط جوي ، و يُعرَّف بأنه القوة التي يمارسها الغلاف الجوي على مساحة سطح معينة.
- يمكننا حساب حجم الضغط الجوي بالمعادلة الآتية:
F = ma
- إذا تخيلنا عمودًا من الهواء 1 في المقطع العرضي يمتد عبر الغلاف الجوي بأكمله ، وتبلغ كتلة هذا العمود 10000 كجم تقريبًا. قوة الجاذبية الهابطة المؤثرة على هذا العمود هي:
F = (10,000 kg)(9.8 m/s2) = 1 × 105 kg-m/s2 = 1 × 105 N
حيث N اختصار لوحدة نيوتن ، و هي الوحدة الدولبة للقوة:
1 N = 1 kg-m/s2
- نظرًا لأن مساحة المقطع العرضي لعمود الهواء لدينا تبلغ 1 متر مربع ، فإن حجم الضغط الجوي عند مستوى سطح البحر

- وحدة القياس الدولية للضغط هي باسكال Pa
1 Pa = 1 N/m2
- و الوحدة المرتبطة بالضغط هي البار:
1 bar = 105 Pa = 105 N/m2
- وحدة ضغط أخرى هي رطل لكل بوصة مربعـة ( psi, lbs/in.2).
- عند مستوى سطح البحر ، يكون الضغط الجوي 14.7 رطل لكل بوصة مربعة = 100 كيلو باسكال = 1 بار.
- في القرن السابع عشر ، اخترع إيفانجليستا تورشيلي البارومتر المصنوع من أنبوب زجاجي يزيد طوله عن 760 مم ومغلق من طرف واحد، ومليء بالزئبق تمامًا ، ومقلوبًا في طبق من الزئبق. يدفع الغلاف الجوي للأرض الزئبق في الطبق لأعلى وتجبر الجاذبية الزئبق في العمود إلى الأسفل، وبالتالي فإن الضغط الناتج عن الزئبق في الأنبوب سيكون مساويًا للضغط الجوي عند قاعدة الأنبوب. لذلك فإن ارتفاع عمود الزئبق ، h ، هو مقياس للضغط الجوي ويتغير مع تغير الضغط الجوي.

الصورة من كتاب : CHEMISTRY THE CENTRAL SCIENCE
- عندما تم رفع البارومتر لأعلى ، ينخفض ارتفاع عمود الزئبق ، لأن الضغط الجوي ينخفض كلما تحركنا إلى أعلى.
- وحدة قياس الضغط الدولية هي باسكال.
- هناك وحدات غير تابعة للنظام الدولي للوحدات تستخدم للتعبير عن ضغط الغاز ، مثل : جو (atm) ومليمتر الزئبق (mm Hg). و torr (نسبة إلى تورشلي Torricelli) وهو و التي تساوي:
1 torr = 1 mm Hg
- مقدار الضغط الجوي القياسي عند سطح البحر يساوي:
1 atm = 760. mm Hg = 760. torr = 1.01325 × 105 Pa = 101.325 kPa = 1.01325 bar
3.10 | قوانين الغازات THE GAS LAWS
- العلاقات التي تعبر عن متغيرات الغاز الاربعة: درجة الحرارة و الضغط و كمية الغاز (عدد المولات) تعرف باسم : قوانين الغاز .
علاقة الضغط-الحجم: قانون بويل
The Pressure–Volume Relationship: Boyle’s Law
- قانون بويل: يتناسب حجم كمية ثابتة من الغاز عكسيا مع الضغـط عند درجة حرارة ثابتـة. و يمكن التعبير عن قانون بويل رياضيًا على النحو الآتي:
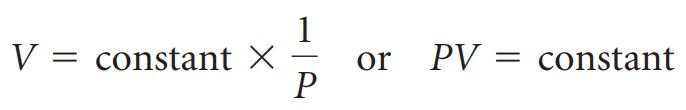
العلاقة بين درجة الحرارة والحجم: قانون تشارلز
The Temperature–Volume Relationship: Charles’s Law
- قانون تشارلز : يتناسب حجم كمية ثابتة من الغاز طرديًا مع درجة حرارته المطلقة عند ضغط ثابت.
- رياضيا ، يأخذ قانون تشارلز الشكل الآتي:
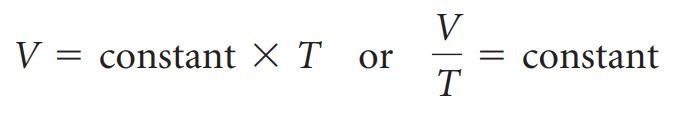
العلاقة بين الكمية والحجم: قانون أفوجادرو
The Quantity–Volume Relationship: Avogadro’s Law
- نظرية أفوجادرو : تحتوي الكميات المتساوية من الغازات عند نفس درجة الحرارة والضغط على أعداد متساوية من الجزيئات.
- يحتوي 22.4 لتر من أي غاز عند درجة حرارة صفر سيليزية و 1 ضغط جوي على 6.02 ×2310 جزيء من الغاز (أي: 1 مول) .
- قانون أفوجادرو : يتناسب حجم الغاز طرديا مع عدد مولات الغاز عند درجة حرارة وضغط ثابتين.
V = constant × n
حيث n هو عدد المولات.
4.10 | معادلة الغاز المثالي THE IDEAL-GAS EQUATION
- طبقا لقوانين الغاز السابقة نجد أن:
- بدمج هذه العلاقات في قانون عام للغاز و استعمال الرمز ∝ للدلالة على ثابت التناسب نحصل على:
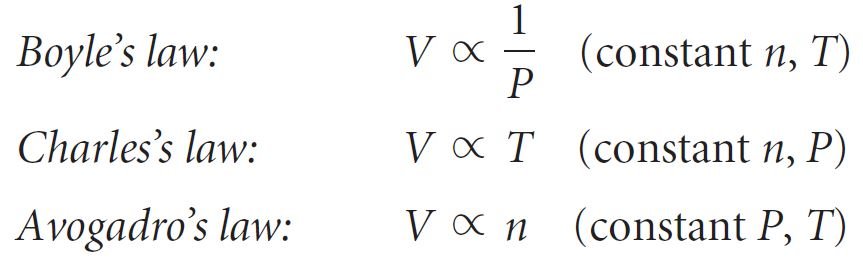
- و من خلال دمج العلاقات السابقة مع بعضها البعض بقانون عام للغاز نحصل على:
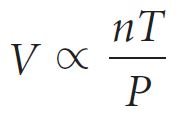
- و إذا أطلقنا على ثابت التناسب R ، نحصل على المعادلة الآتية:
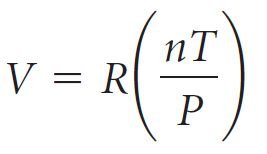
- من خلال إعادة ترتيب المعادلة أعلاه ، نحصل على معادلة جديدة تسمى معادلة الغاز المثالي (وتسمى أيضًا قانون الغاز المثالي).
PV = nRT
- حيث R هي ثابت الغاز و قيمتها و وحدتها تعتمد على وحدات الضغط و الحجم و عدد المولات و درجة الحرارة.
- إن الوحدة المستخدمة للتعبير عن درجة الحرارة في معادلة الغاز المثالي هي الكلفن ، و كمية الغاز n هي المول ، أما الوحدات المستخدمة للتعبير عن الضغط و الحجم على الأغلب هي الضغط الجوي (جو) و اللترات على التوالي.
- إن قيمة R تساوي 0.08206 لتر. جو/مول. كلفن
عند الظروف التي يكون عندها درجة الحرارة 0 درجة سيليزية و الضغط الجوي يساوي 1 جو فإنه يطلق عليهما مصطلح درجة الحرارة والضغط القياسيان (STP). - يُعرف الحجم الذي يشغله 1 مول من الغاز المثالي عند STP و الذي يساوي 22.41 لتر ، بالحجم المولي للغاز المثالي .
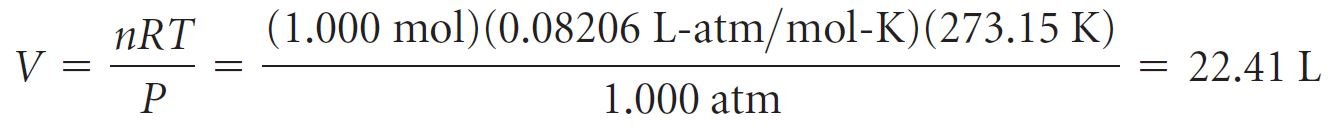
العلاقة بين معادلة الغاز المثالي و قوانين الغازات
Relating the Ideal-Gas Equation and the Gas Laws
- إن قوانين الغاز هي حالات خاصة لمعادلة الغاز المثالي. على سبيل المثال ، عند ثبوت كلا من n و T ، فإن الناتج nRT يحتوي على ثلاثة ثوابت وبالتالي بحد ذاته يصبح ثابتًا ، و عليه نتوصل على قانون بويل.
PV = nRT = constant or PV = constant
- نظرًا لأن الناتج PV ثابت عند ثبوت كلا من n و T ، فإننا نحصل على
P1V1 = P2V2
حيث P1 و V1 القيم الابتدائية و P2 و V2 القيم النهائية .
- بطريقة مماثلة ، يمكننا البدء بمعادلة الغاز المثالي واشتقاق العلاقات بين أي متغيرين آخرين ، الحجم و درجة الحرارة (قانون تشارلز) ، الكمية و الحجم (قانون أفوجادرو) ، أو الضغط و درجة الحرارة.
- و لكون n ثابت لعدد ثابت من مولات الغاز ،فإنه يمكن إعادة كتابة معادلة الغاز المثالي على النحو الآتي:
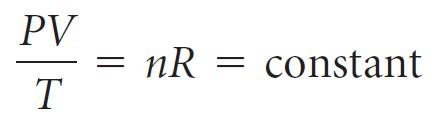
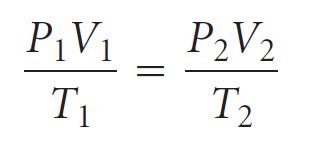
- غالبًا ما تسمى هذه المعادلة بقانون الغاز الجامع.
5.10 | المزيد من التطبيقات لمعادلة الغاز المثالي
FURTHER APPLICATIONS OF THE IDEAL-GAS EQUATION
الكثافات و الكتل المولية للغاز
Gas Densities and Molar Mass
- باستخدام المعادلة التالية يمكننا حساب كثافة أي غاز

حيث d هي كثافة الغاز و M الكتلة المولية للغاز,
- كما يمكن إعادة ترتيب المعادلة الأخيرة لإيجاد الكتلة المولية للغاز:
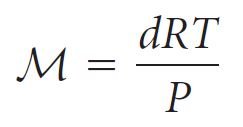
حجوم الغازات في التفاعلات الكيميائية
Volumes of Gases in Chemical Reactions
- من المفيد أن نكون قادرين على حساب حجوم الغازات المستهلكة أو الناتجة في التفاعلات. و تستند هذه الحسابات على مفهوم المول والمعادلات الكيميائية الموزونة.
- تخبرنا المعاملات في معادلة كيميائية موزونة عن الكميات النسبية (بالمولات) للمواد المتفاعلة و الناتجة في التفاعل.
- ترتبط معادلة الغاز المثالي عدد مولات الغاز بـ P و V و T.
6.10 | مخاليط الغازات و الضغوط الجزئية
GAS MIXTURES AND PARTIAL PRESSURES
- قانون دالتون للضغوط الجزئية : إن الضغط الكلي لمزيج من الغازات يساوي مجموع الضغوط التي يمكن أن يمارسها كل منها كما لو كانت موجودة بمفردها.
- يسمى الضغط الذي يمارسه أحد مكونات الخليط الغازي بالضغط الجزئي لهذا المكون أو الغاز.
- يمكننا كتابة قانون دالتون للضغوط الجزئية على النحو الآتي
حيث Pt الضغط الكلي لمزيج من الغازات و P1 و P2 و P3 وما إلى ذلك هو الضغوط الجزئية للغازات كلا على حدة. - تشير هذه المعادلة إلى أن كل غاز يتصرف بشكل مستقل عن الآخرين.
- لنفترض أن n1 و n2 و n3 وما إلى ذلك هو عدد مولات كل غاز في الخليط و nt هو العدد الإجمالي لمولات الغاز. فإذا امتثل كل غاز لمعادلة الغاز المثالي ، فيمكننا الكتابة

- بالتعويض في المعادلة السابقة في هذه الصفحة نحصل على:
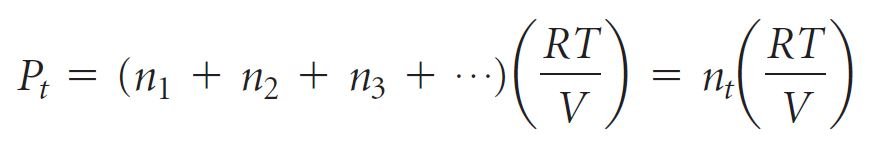
الضغوط الجزئية والكسور الجزيئية
Partial Pressures and Mole Fractions
- يمكننا ربط كمية غاز معين في خليط بضغطه الجزئي. فللغاز المثالي ، يمكننا كتابة العلاقة الآتية:
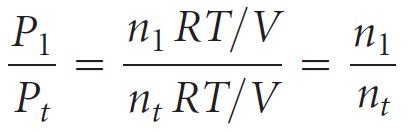
- تعرف النسبة n1/n2 باسم الكسر الجزيئي للغاز 1 ، والذي نشير إليه بالرمز X1. فالكسر المولي ، X ، هو رقم بدون أبعاد و يعبر عن نسبة عدد مولات لمكون واحد في خليط
- لذلك للغاز رقم 1 فإنه يكون لدينا

و بدمج العلاقات السابقة مع بعضها البعض نحصل على:
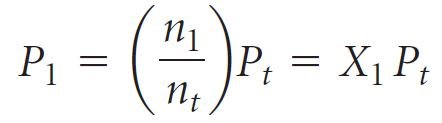
تجميع الغازات فوق الماء Collecting Gases over Water
- يتم قياس حجم الغاز المُجمع برفع الزجاجة أو خفضها حسب الضرورة حتى تتساوى مستويات الماء داخل وخارج الزجاجة. عند استيفاء هذا الشرط ، يكون الضغط داخل الزجاجة مساويًا للضغط الجوي.
- إجمالي الضغط الداخلي هو مجموع ضغط الغاز المجمع وضغط بخار الماء في حالة توازن مع الماء السائل:
Ptotal = Pgas + PH2O
7.10 | نظرية الحركة الجزيئية للغازات
THE KINETIC-MOLECULAR THEORY OF GASES
- لفهم الخصائص الفيزيائية للغازات ، نحتاج إلى نموذج يساعدنا في تصور ما يحدث لجزيئات الغاز عندما تتغير ظروف مثل الضغط أو درجة الحرارة. و مثل هذا النموذج يعرف بنظرية الحركية الجزيئية للغازات والتي تتلخص في الفقرات الآتية:
- تتكون الغازات من أعداد كبيرة من الجزيئات تكون في حركة عشوائية مستمرة.
- مجموع أحجام جميع الجزيئات أصغر كثير عن حجم الوعاء الموجودة فيه.
- إن القوى التجاذب و التنافر بين جزيئات الغاز تكاد أن تكون معدومة.
- يمكن نقل الطاقة بين الجزيئات أثناء الاصطدامات ، ولكن طالما ظلت درجة الحرارة ثابتة ، فإن متوسط الطاقة الحركية للجزيئات لا يتغير بمرور الوقت.
- يتناسب متوسط الطاقة الحركية للجزيئات مع درجة الحرارة المطلقة. وفي أي درجة حرارة معينة ، تمتلك جزيئات جميع الغازات نفس متوسط الطاقة الحركية.
- يحدث ضغط الغاز نتيجة اصطدام الجزيئات بجدران الحاوية.
- درجة الحرارة المطلقة للغاز هي مقياس لمتوسط الطاقة الحركية لجزيئاته. فإذا تمت مضاعفة درجة الحرارة المطلقة للغاز ، يتضاعف متوسط الطاقة الحركية لجزيئاته. وبالتالي ، تزداد الحركة الجزيئية مع زيادة درجة الحرارة.
توزيعات السرعة الجزيئية
Distributions of Molecular Speed
- تتحرك الجزيئات الفردية بسرعات مختلفة.
- في أي لحظة ، تتمتع الجزيئات الموجودة في العينة بمدى واسع من السرعات.
- نظرًا لأن الكتلة لا تتغير مع درجة الحرارة ، فإن الزيادة في متوسط الطاقة الحركية مع زيادة درجة الحرارة تعني أن سرعة جذر متوسط التربيع (سرعة جذر متوسط التربيع (rms) ، urms) للجزيئات (بالإضافة إلى سرعتها المتوسطة) تزداد مع زيادة زيادة درجة الحرارة.
- سرعة جذر متوسط التربيع مهمة لأن متوسط الطاقة الحركية لجزيئات الغاز في العينة يساوي:
½m(urms)2
تطبيق النظرية الحركية الجزيئية على قوانين الغاز
Application of Kinetic-Molecular Theory to the Gas Laws
- تؤدي الزيادة في الحجم عند درجة حرارة ثابتة إلى انخفاض الضغط.
- تؤدي زيادة درجة الحرارة عند الحجم الثابت إلى زيادة الضغط.
8.10 | الانتشار و التسرب الجزيئي
MOLECULAR EFFUSION AND DIFFUSION
- متوسط الطاقة الحركية لأي مجموعة من جزيئات الغاز ، له قيمة محددة عند درجة حرارة معينة.
- بالنسبة لغازين عند نفس درجة الحرارة ، يكون للغاز المكون من جزيئات منخفضة الكتلة نفس متوسط الطاقة الحركية للغاز الذي يتكون من جزيئات أكثر ضخامة.
- يجب أن يكون للجسيمات ذات الكتلة الأصغر سرعة جذر متوسط التربيع أعلى من الجسيمات ذات الكتلة الأعلى.
- المعادلة التي تعبر عن هذه الحقيقة من الناحية الكمية هي:
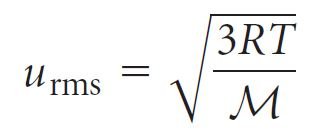
حيث M الكتلة المولية للجسيمات.
- يمكن أيضًا اشتقاق السرعة المحتملة لجزيء الغاز:

قانون جراهام للتسرب Graham’s Law of Effusion
- إذا كانت معدلات تسرب الغازين هي r1 و r2 وكانت كتلتهما المولية M1 و M2 ، فإن قانون جراهام ينص على ما يلي:
- علاقة تشير إلى أن الغاز الأخف له معدل تسرب أعلى.
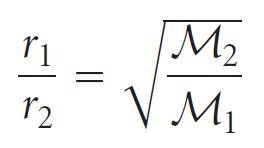
- معدل التسرب يتناسب طرديا مع سرعة جذر متوسط التربيع للجزيئات. و لأن R و T ثابتان فإنه يكون لدينا
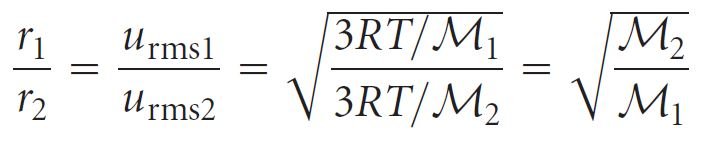
- كما هو متوقع من قانون جراهام ، يتسرب الهيليوم من الحاويات عبر ثقب صغير بسرعة أكبر من الغازات الأخرى ذات الوزن الجزيئي الأعلى.
بوسترات (لوحات) كيميائية بدقة عالية (أكثر من 25 لوحة) من تصميم الأستاذ أكرم أمير العلي
تطبيقات كيميائية من تصميم الأستاذ أكرم امير العلي متوفر للجوالات التي تعمل بنظام أندرويد android على سوق جوجل بلاي google play
1 – تطبيق ملصقات الجدول الدوري باللغة العربية : بطاقات تحتوي على معلومات شاملة و مختصرو في نفس الوقت كل عنصر على حدة (اللغة العربية).
https://play.google.com/store/apps/details?id=com.akramir2
2 – تطبيق ملصقات كيميائية: ملصقات بتصميم جميل جدا للكواشف و الأدلة و الزجاجيات المستخدمة في المختبر و كذلك ملصقات و بطاقات لخزانات حفظ المواد و الأدوات الزجاجية .
https://play.google.com/store/apps/details?id=com.akramir
3 – إذا كنت تواجه صعوبة في تحضير المحاليل الكيميائية الأكثر شيوعا في مختبرات الكيمياء و الاحياء، فهذا التطبيق سوف يساعدك كثيرا في تحضير المحاليل :
مقالات قد تفيدك :
 مصادر الكيمياء موقع لتعليم الكيمياء بصورة مبسطة
مصادر الكيمياء موقع لتعليم الكيمياء بصورة مبسطة