سلسلة النشاط reactivity series
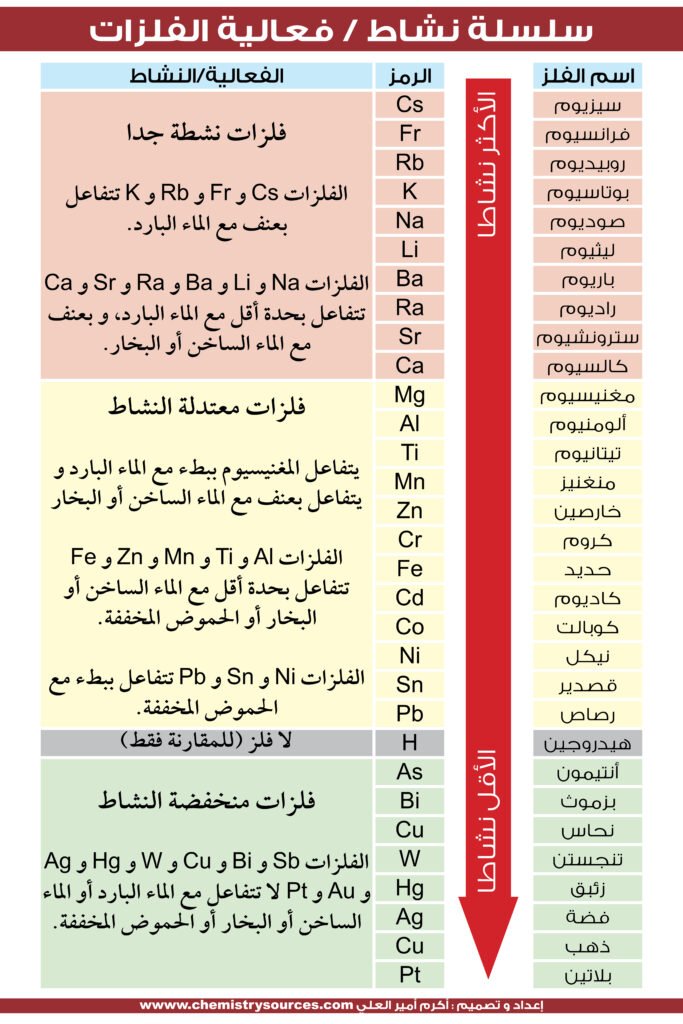
سلسلة النشاط reactivity series : هي قائمة بالفلزات مرتبة من الأكثر نشاطا (تفاعلًا) إلى الأقل نشاطا (تفاعلًا) . و تساعدك معرفة سلسلة النشاط على توقع حدوث تفاعل كيميائي أم لا. على وجه التحديد ، يمكن استخدامه لتحديد ما إذا كان الفلز يتفاعل مع الماء أو الحمض أو ما إذا كان يحل محل فلز آخر في التفاعل.
و إذا نظرت في عدة مراجع ستلاحظ أن المخططات من مصادر مختلفة قد ترتب العناصر بشكل مختلف قليلاً. على سبيل المثال ، في بعض المخططات ستجد الصوديوم مدرجًا على أنه أكثر تفاعلاً من البوتاسيوم. هذا لأن شروط التفاعل المقترح مهمة. كما يأتي ترتيب الفلزات في المخطط من البيانات التجريبية حول قدرة المعدن على إزاحة الهيدروجين من الماء والحمض. فبعض الفلزات تتفاعل مع حمض أكثر من الآخر ، بالإضافة إلى أن درجة الحرارة تلعب دورًا في هذا الموضوع.
المهم هو مراعاة الاتجاهات العامة. فالفلزات القلوية أكثر تفاعلاً من الفلزات القلوية الترابية والتي بدورها تكون أكثر تفاعلاً من الفلزات الانتقالية.
أهمية جدول سلسلة النشاط
من خلال دراستنا لذلك الجدول نستطيع ان نحسب جهد الخلية Eo في الظروف المعيارية و كذلك مقارنة قوة العوامل المؤكسدة و المختزلة و أخيرا التنبؤ بالتفاعلات ، فمثلا :
1 – يزيل الخارصين الأكسحين من مركب أكسيد النحاس (II) و لكن لا يمكن للنحاس أن يزيل الأكسحين من أكسيد الخارصين.
2 – يمكن للهيدروجين إن يختزل أكسيد النحاس (II) و لكن لا يمكنه فعل ذلك مع أكسيد الخارصين.
3- لا يمكن للنحاس أن يتفاعل مع الحموض لتحرير الهيدروجين.
و في هذه السلسة تم ترتيب العناصر طبقا لنشاطها الكيميائي الأكثر نشاطا في الأعلى و الأدنى نشاطا في الأسفل ، فمثلا الصوديوم أكثر نشاطا من المغنيسيوم و الألومنيوم ، و المغنيسيوم أكثر نشاطا من الخارصين و النحاس و الخارصين أكثر نشاطا من الحديد و الفضة . فالأكاسيد تختزل بالعناصر التي أعلى العناصر و ليس أسفلها:
CuO + Mg → MgO + Cu
MgO + Cu → لا يحدث تفاعل
و تختزل أيونات الفلزات من العناصر التي أعلاها و ليست التي أسفلها :
2Ag + Zn → Zn2+ + 2Ag
Zn2+ + Ag → لا يحدث تفاعل
فكلما انتقلنا في السلسلة من أسفل لأعلى ، كان تفاعل العنصر مع الماء أو الحموض أكثر نشاطا و عنفا . فالصوديوم يتفاعل بعنف مع الماء البارد ، بينما المغنيسيوم يتفاعل ببط مع الماء البارد و لكنه بعنف مع بخار الماء . سلسلة النشاط تشمل فقط الفلزات بينما سلسلة النشاط الكهربائي تشمل اللافلزات أيضا.
بوسترات (لوحات) كيميائية بدقة عالية (أكثر من 25 لوحة) من تصميم الأستاذ أكرم أمير العلي
تجارب كيميائية سهلة و شيقة و ممتعة (10) Amazing Chemistry Experiments
تطبيقات كيميائية من تصميم الأستاذ أكرم امير العلي متوفر للجوالات التي تعمل بنظام أندرويد android على سوق جوجل بلاي google play
1 – تطبيق ملصقات الجدول الدوري باللغة العربية : بطاقات تحتوي على معلومات شاملة و مختصرو في نفس الوقت كل عنصر على حدة (اللغة العربية).
https://play.google.com/store/apps/details?id=com.akramir2
مقالات قد تفيدك :
 مصادر الكيمياء موقع لتعليم الكيمياء بصورة مبسطة
مصادر الكيمياء موقع لتعليم الكيمياء بصورة مبسطة