المركبات العطرية Aromatic Compounds : ملاحظة هامة: هذا المقال عبارة عن مختصر للفصل الرابع من كتاب : Organic Chemistry A Short Course, 13th Edition تأليف: David J. Hart و Christopher M. Hadad و Leslie E. Craine و Harold Hart
قبل البدء في شرح هذا الفصل: هذه قائمة لباقي الفصول من هذا الكتاب مع الرابط الخاص بكل فصل
الفصل الأول : الترابط و التصاوغ Bonding and Isomerism
الفصل الثاني: الألكانات و الألكانات الحلقية و التصاوغ الهئية و الهيكلي Alkanes and Cycloalkanes; Conformational and Geometric Isomerism
الفصل الثالث: الألكينات و الألكاينات Alkenes and Alkynes
الفصل الخامس: التصاوغ الفراغي Stereoisomerism
الفصل السادس : مركبات الهالوجينات العضوية، تفاعلات الاستبدال و الحذف Organic Halogen Compounds; Substitution and Elimination Reactions
الفصل السابع : الكحولات و الفينولات و الثيولات Alcohols, Phenols and Thiols
الفصل الثامن: الإيثرات و الإيبوكسيدات Ethers and Epoxides
الفصل التاسع: الألدهيدات و الكيتونات Aldehydes and Ketones
الفصل العاشر: الحموض الكربوكسيلية (الاحماض الكربوكسيلية) و مشتقاتها Carboxylic Acids and Their Derivatives
الفصل الحادي عشر:الأمينات و مركبات النيتروجين المتعلقة بها Amines and Related Nitrogen Compounds
الفصل الثاني عشر (فقط NMR) : التحليل الطيفي و تحديد البنية الكيميائية – مطيافية الرنين النووي المغناطيسي NMR
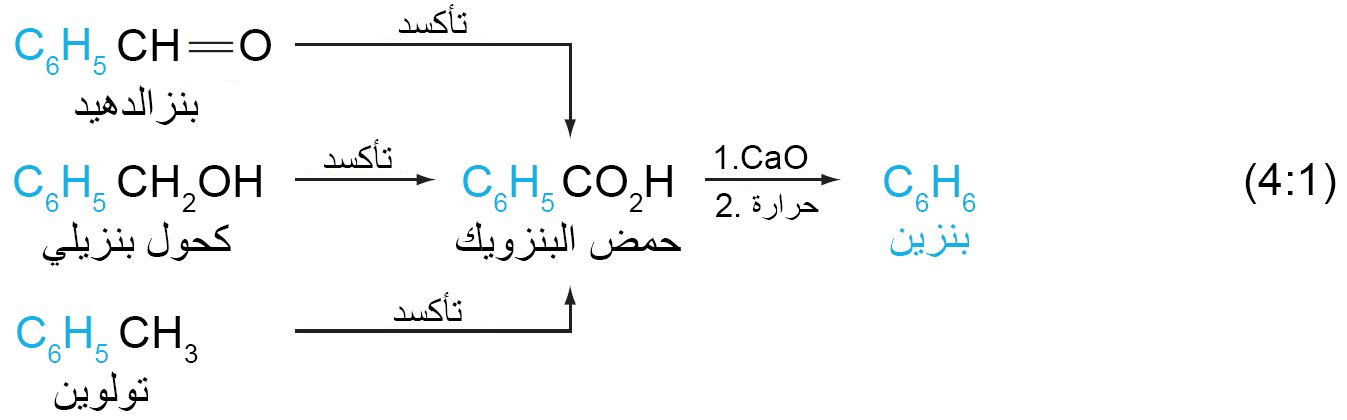
- العديد من المواد العطرية لها تراكيب بسيطة. يحتوي الكثير منها على مجموعة مكونة من ستة ذرات كربون.
- و هذه المجموعة هي C6H5– ، وهي شائعة في العديد من المواد ، بما في ذلك البنزالديهايد ، والكحول البنزيلي ، والتولوين.
- عندما يتأكسد أي من هذه المركبات الثلاثة ، تظل مجموعة C6H5 سليمة و سكون الناتج عن تأكسدها هو حمض البنزويك.
- عندما يتم تسخين ملح الكالسيوم لهذا الحمض ينتج عنه الهيدروكربون الأصلي C6H6.
1 – بعض الحقائق حول البنزين Some Facts About Benzene
- للبنزين C6H6 بُنية (تركيب) غير مشبعة كثيرا.
- لا يتصرف البنزين كما لو كان غير مشبع ، فهو لا يزيل لون محلول البروم بالطريقة التي تعمل بها الألكينات و الألكاينات ، كمال أنه لا يتأكسد بسهولة بواسطة برمنجنات البوتاسيوم.
- لا يخضع البنزين لتفاعلات الإضافة النموذجية للألكينات أو الألكاينات.
- يتفاعل البنزين بشكل أساسي عن طريق تفاعلات الاستبدال.


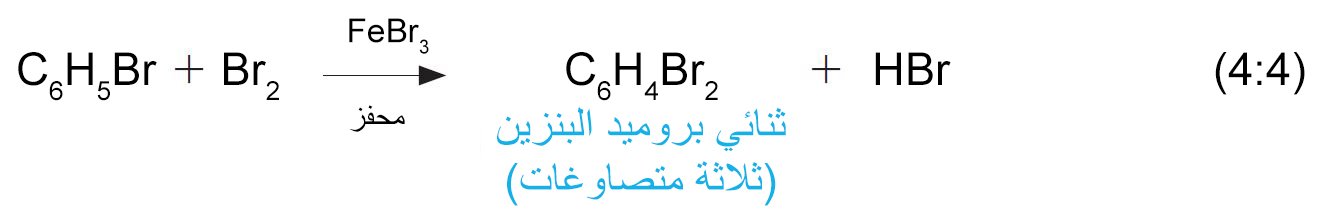
- عندما يتم معالجة بروميد البنزين مع جزيء بروم آخر باستخدام نفس العامل المحفز، يتم الحصول على ثلاثة مصاوغات من ثنائي بروميد البنزين.
2 – تركيب كيكولي للبنزين The Kekule Structure of
Benzene
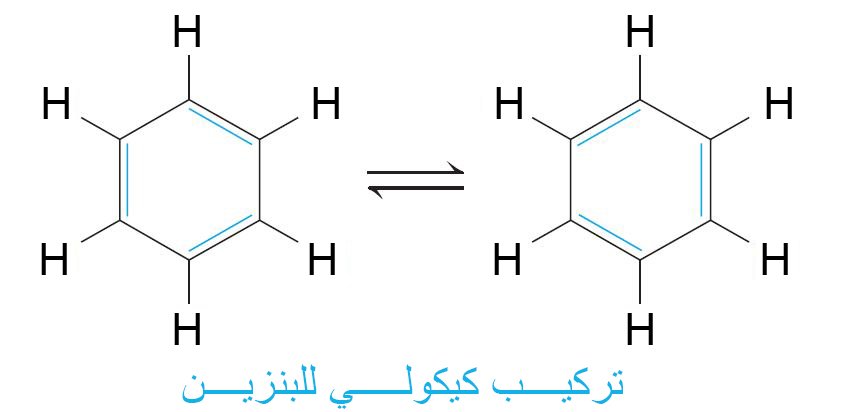
- في عام 1865 ، اقترح كيكولي بنية معقولة للبنزين.
- توجد ذرات الكربون الستة في زوايا شكل سداسي منتظم ، مع ذرة هيدروجين واحدة متصلة بكل ذرة كربون.
- اقترح أن تتناوب الروابط الأحادية و الثنائية حول الحلقة.
- اقترح كيكولي أن يتم تبادل الروابط الأحادية و الثنائية حول الحلقة بسرعة كبيرة بحيث لا يمكن أن تحدث التفاعلات النموذجية للألكينات.
3- نموذج الرنين للبنزين Resonance Model of Benzene
- إن نموذج كيكولي لتركيب البنزين ليس صحيحا تماما.
- إن تركيبي كيكولي للبنزين يختلفان فقط في توزيع الإلكترونات (الروابط الأحادية و الثنائية) و لكن تبقي جميع الذرات في مكانها في كالا التركيبين. إن التركيب الحقيقي للبنزين هو رنين مهجن لكلا تركيبي البنزين.
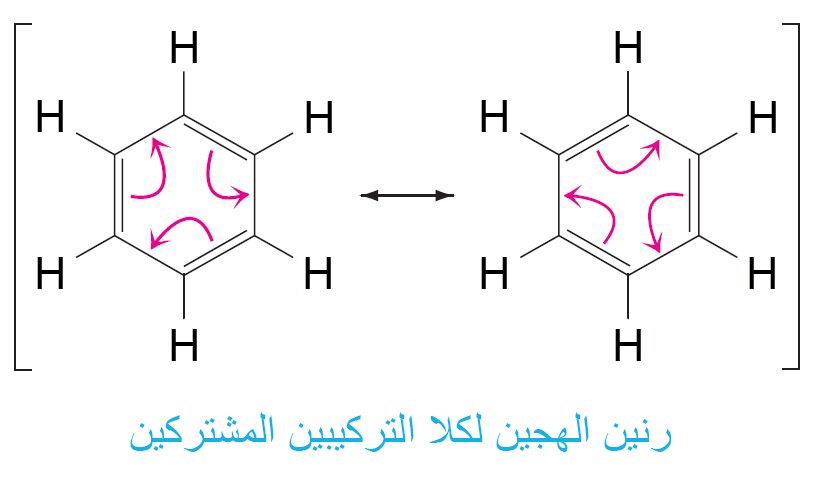
- جميع جزيئات البنزين متماثلة ، والبنية رنين المهجن للبنزين أكثر استقرارًا من أي من تراكيب (بُنيات) كيكولي الداخلة في تركيب الرنين.
- يوجد في البنزين نوع واحد فقط من رابطة الكربون – الكربون، و نوع هذه الرابطة يكون وسطا بين الرابطة الأحادية و الرابطة الثنائية.
- إن تركيب البنزين مستو ، وكل ذرة كربون تقع في زاوية شكل سداسي منتظم. جميع أطوال الروابط بين الكربون والكربون متطابقة و تساوي 1.39 أنجستروم ، و هذه القيمة تقع وسطا بين طول الرابطة الفردية الكربون-الكربون (1.54 أنجستروم) و الرابطة الثنائية الكربون-الكربون (1.34 أنجستروم).
4- النموذج الفلكي للبنزين Orbital Model for Benzene
- كل ذرة كربون في البنزين تكون متصلة مع ثلاثة ذرات أخرى فقط. (ذرتي كربون و ذرة هيدروجين).
- لذلك يكون تهجين كل ذرة كربون من نوع sp2 .
- يتداخل فلكين من أفلاك sp2 لكل ذرة كربون مع الأفلاك المشابه لها لذرات الكربون المجاورة لها مكونة روابط من نوع سيجما تشكل أضلاع الحلقة السداسية.
- أما فلك sp2 الثالث فإنه يتداخل مع فلك الهيدروجين 1s مشكلة رابطة سيجما C-H .
- تعمل أفلاك p العمودية على ذرات الكربون الستة على التداخل لتشكل أفلاك باي و التي تشكل حلقة أو سحابة من الإلكترونات فوق و أسفل مستوى الحلقة.
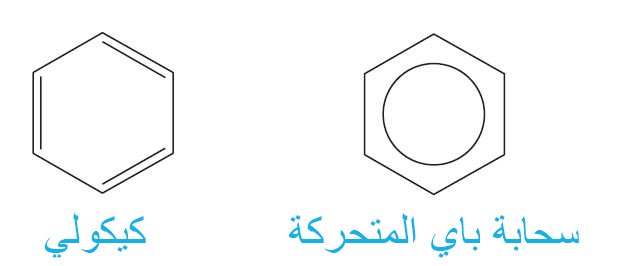
5- رموز البنزين Symbols for Benzene
- يتم استخدام رمزين لتمثيل البنزين. أحدهما هو تركيب كيكولي ، والآخر عبارة عن حلقة سداسية بداخلها حلقة دائرية.
- في هذا المختصر سوف نقوم باستخدام رمز كيكولي.
6- تسمية المركبات العطرية Nomenclature of Aromatic Compounds
- اكتسبت الأسماء الشائعة للمركبات العطرية الاحترام التاريخي و تم اعتمادها من قبل IUPAC. و الامثله على ذلك يشمل:
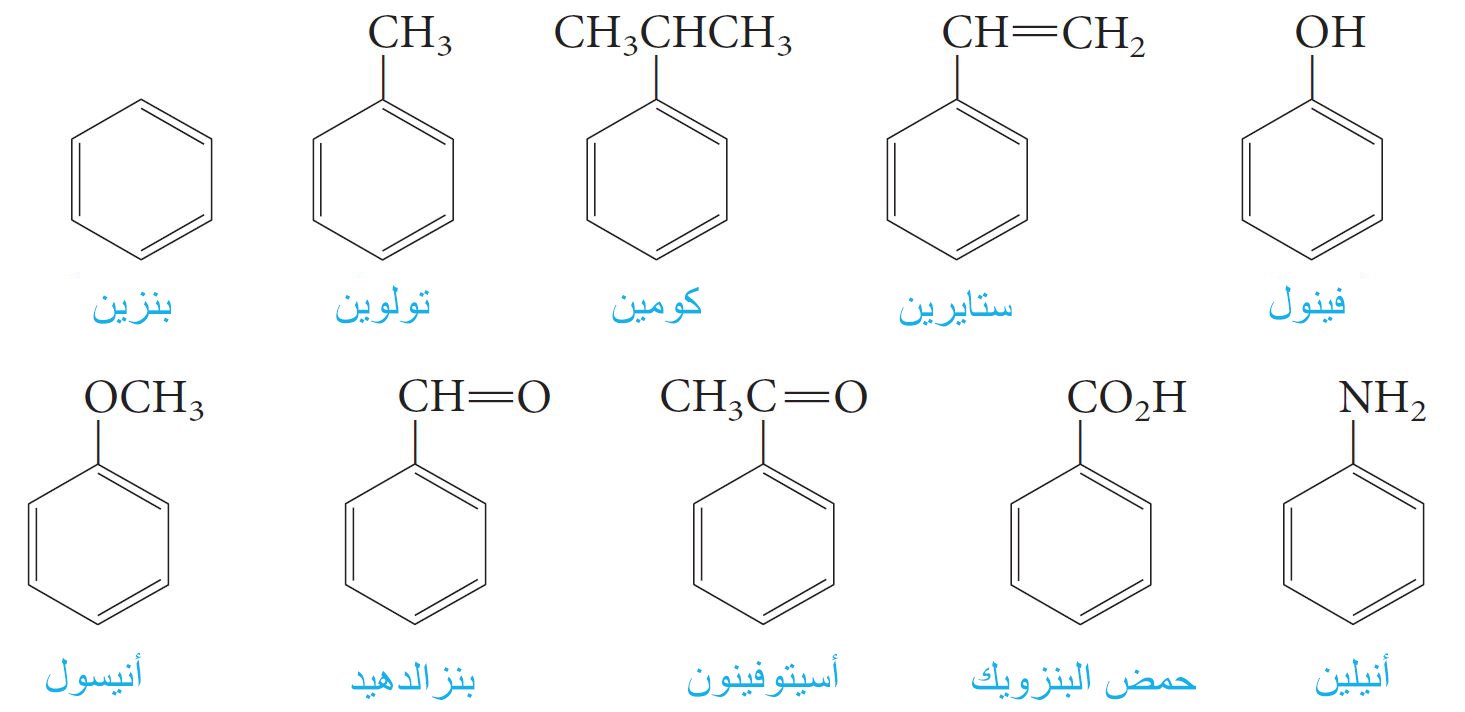
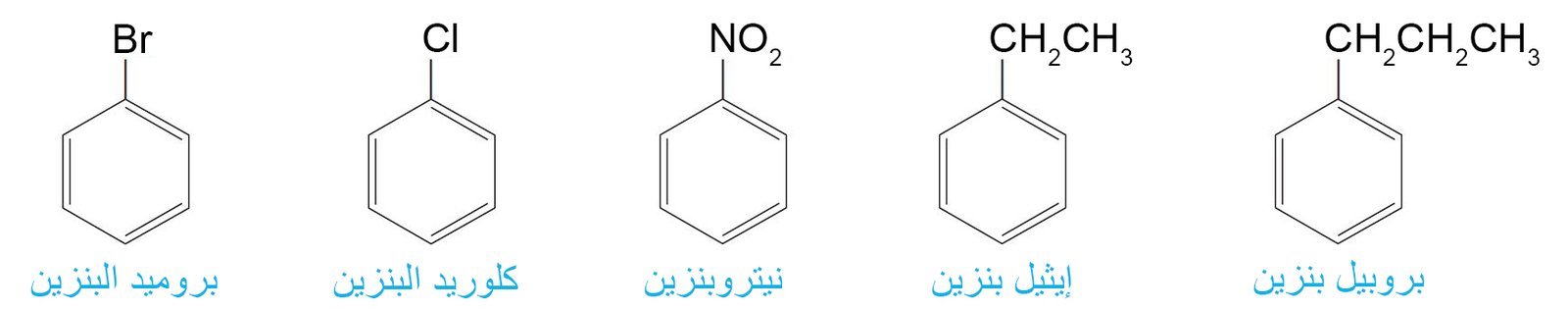
- يتم تسمية مركبات البنزين التي تم استدال واحدة منها والتي ليس لها أسماء شائعة مقبولة من قبل IUPAC ، على أنها مشتقات للبنزين.
- عندما يكون هناك بديلان ، فسوف يكون ثلاثة تراكيب تصاوغية ممكنة. ويتم تحديدها بواسطة البادئات أورثو و ميتا و بارا ، والتي عادة ما يتم اختصارها على شكل o- و m- و p- على التوالي.
- إذا تم ربط المجموعة البديلة X بالموقع أورثو فإنه يقصد به الكربون رقم 2 أو رقم 6 ، و إذا كان الربط بالموقع ميتا فإنه يقصد به ذرة الكربون 3 أو 5 ، أما إذا كان الربط في الموقع بارا فإنه يقصد به ذرة الكربون رقم 4.
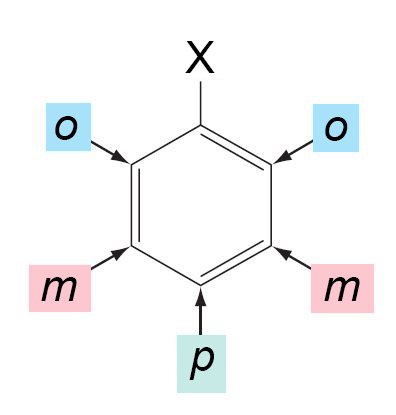

- يتم استخدام البادئات أورثو و ميتا و بارا حتى عندما يكون المجموعتين البديلتبن غير متطابقين.

- تسمى العطريات الهيدروكربونية كصنف من أصناف المركبات العضوية باسم الأرينات.
يستخدم الرومز Ar للدلالة على مجموعة الأريل.
يقصد بالصيغة Ar-R أي مجموعة أريل ألكان. - هناك مجموعتان و لهما اسمين خاصين بهما توجدان بصورة متكررة في المركبات العطرية ، و هما مجموعة الفينيل و مجموعة البنزيل.
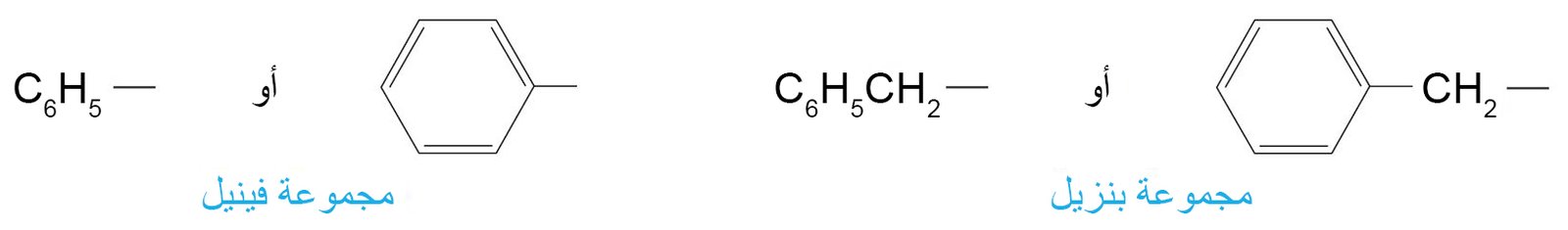
- أحيانا يتم استخدام الاختصار Ph للدلالة على مجموعة الفينيل.
7- طاقة الرنين للبنزين The Resonance Energy of Benzene
- اسم الأيوباك لتركيب كيكولي للبنزين هو : 5،3،1 – حلقي سداسي الترايين.
- إن تفاعل هدرجة الرابطة الثنائية بين الكربون-الكربون طارد للحرارة و كمية الطاقة (الحرارة) المحررة ما بين 26-30 كيلوكالوري/مول لكل رابطة ثنائية ، و تتضاعف كمية هذه الطاقة اللازمة إذا ما تم هدرجة رابطتين ثنائيتبن في المركب ، و هكذا دواليك.
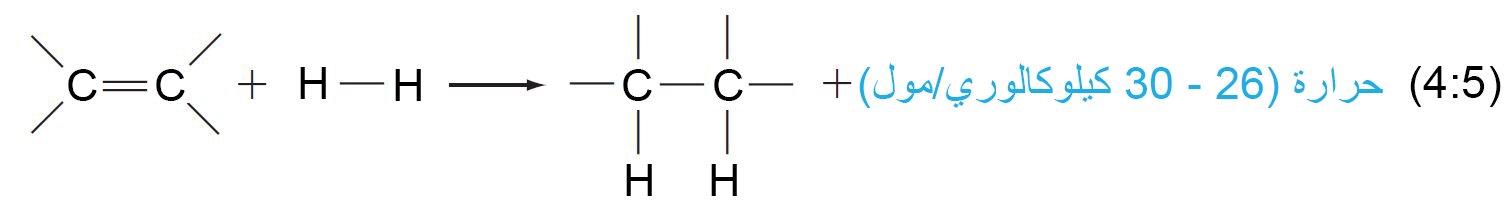
- إن هدرجة الهكسين الحلقي تحرر 28.6 كيلو كالوري/مول و لـ ـ 3،1 – هكسادايين الحلقي يتم تحرير 55.4 كالوري/ مول (ضعف الكمية للهكسين الحلقي تقريبا).
- يصعب هدرجة البنزين مقارنة مع الألكينات البسيطة ، و كمية الحرارة المنطلقة عند هدرجة البنزين أقل بكثير من المتوقع: فقط 49.8 كيلو كالوري/مول.
- أما هدرجة تركيب كيكولي فإنه نظريا يجب أن يساوي نظريًا هدرجة ثلاث روابط ثنائية أو حوالي 84 إلى 86 كيلو كالوري / مول.
- تكون جزيئات البنزين الحقيقية أكثر ثباتًا من التراكيب المساهمة في تركيب الرنين بحوالي 36 كيلو كالوري/ مول (86 – 50 = 36).
- إن طاقة الاستقرار ، أو طاقة الرنين ، لمادة ما هي الفرق بين طاقة الجزيء الحقيقي والطاقة المحسوبة للبنية (التركيب) المساهمة الأكثر ثباتًا.
- يتفاعل عادة البنزين والمركبات العطرية الأخرى بطريقة تحافظ على تركيبتها العطرية وبالتالي تحافظ على طاقر رنينها.
8- الاستبدال الإلكتروفيلي العطري Electrophilic Aromatic Substitution
- إن أغلب التفاعلات العطرية الأكثر شيوعا تتطلب استبدال ذرات أو مجموعات لذرات الهيدروجين المتصلة بالحلقة العطرية.
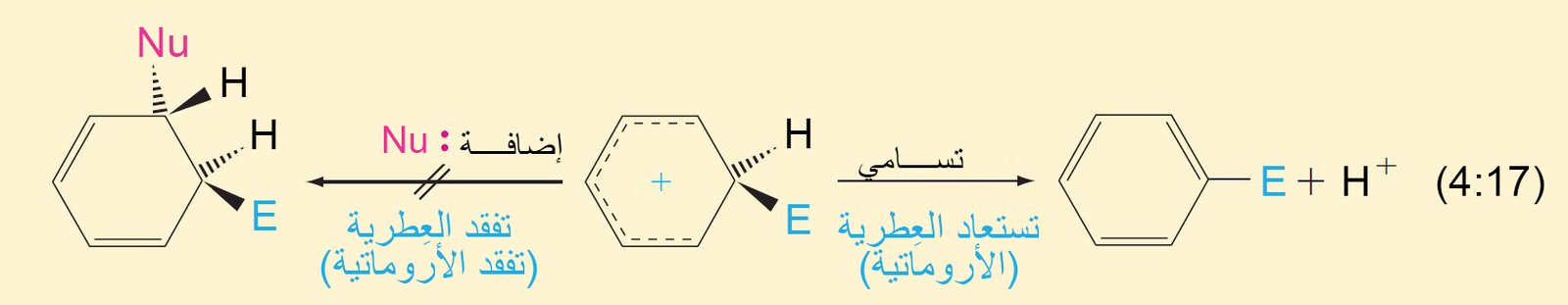
9- ميكانيكية الاستبدال الإلكتروفيلي العطري The Mechanism of Electrophilic Aromatic Substitution
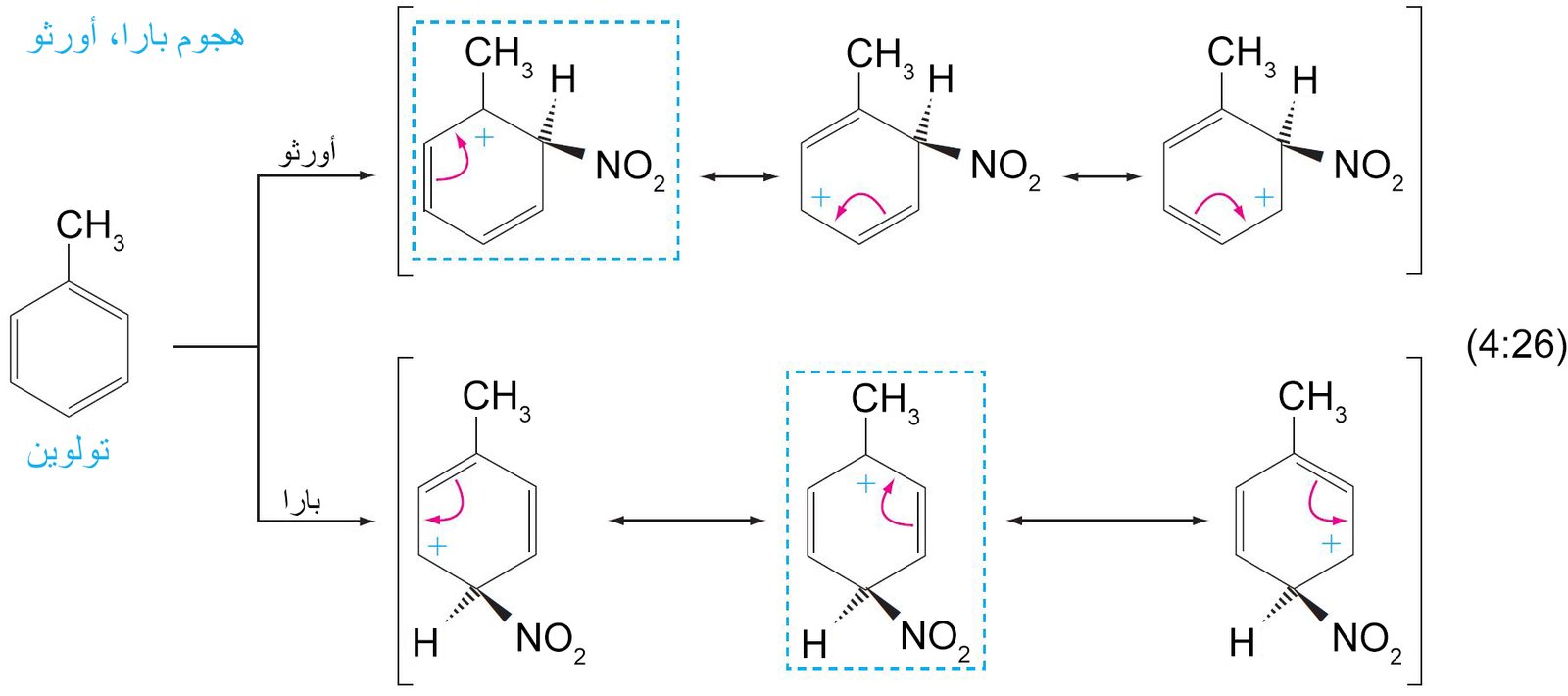
- تتطلب جميع تفاعلات الاستبدال هجومًا أوليًا على حلقة البنزين بواسطة الإلكتروفيل.
- في تفاعل الاستبدال ، يلزم وجود محفز ، ويعمل كحمض لويس حيث يحول الإلكتروفيل الضعيف إلى إلكتروفيل قوي كما هو موضح أدناه

- يرتبط الإلكتروفيل بذرة كربون واحدة من تلك الموجود في حلقة البنزين من خلال رابطة سيجما.
- يصبح التهجين الحاصل في ذرة الكربون من نوع sp3 .
- تعمل إلكترونات باي في حلقة البنزين كمانحة لإلكترونات باي أو تعمل كنيوكليوفيل، حيث تقوم هذه الإلكترونات بمهاجمة الإلكتروفيل حيث ترتبط إلكترونات باي π مع الإلكتروفيل برابطة تساهمية على شكل رابطة سيجما.
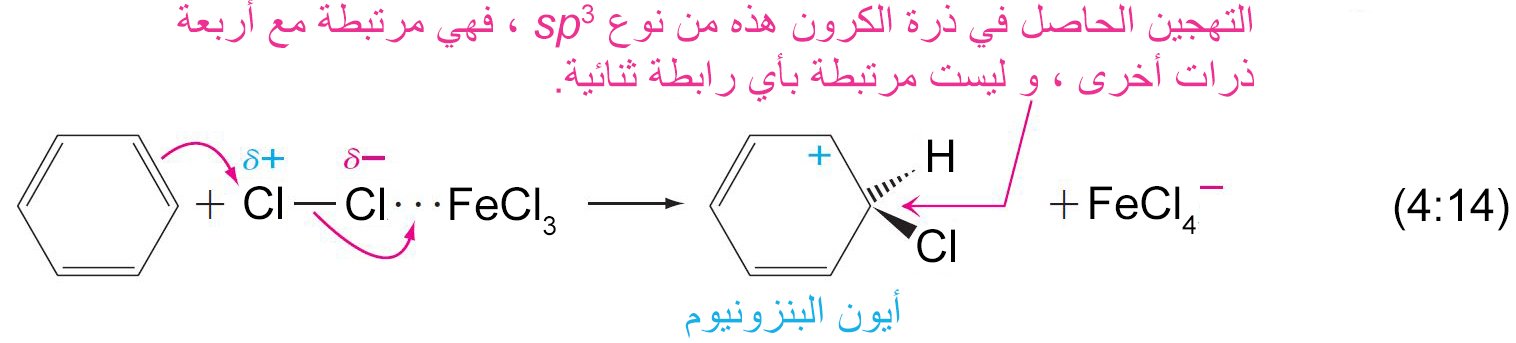
- إن الكربوكاتيون الناتج عن ارتباط الإلكتروفيل بحلقة البنزين يطلق عليه اسم أيون البنزونيوم ، حيث تتحرك فيه الشحنة الموجبة من خلال الرنين إلى ذرات الكربون الأورثو و البارا وصولا إلى ذرة الكربون التي ترتبط معها مجموعة الإلكتروفيل.

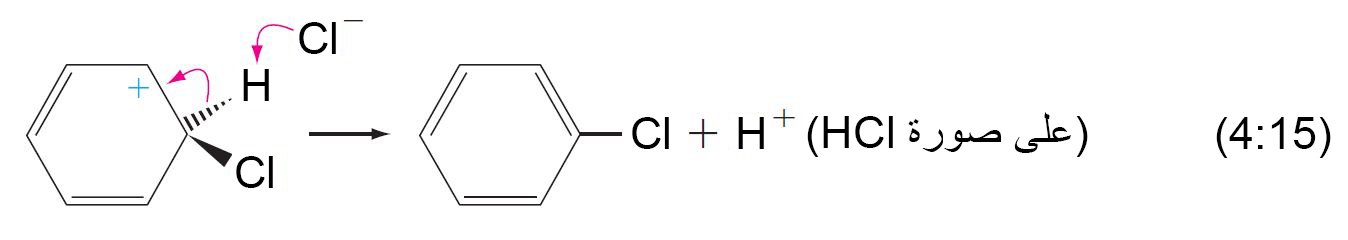
- تكتمل عملية الاستبدال من خلال فقدان البروتون (+H) من ذرة الكربون ذات التهيجين sp3 و هي الذرة نفسها التى ترتبط معها الإلكتروفيل.
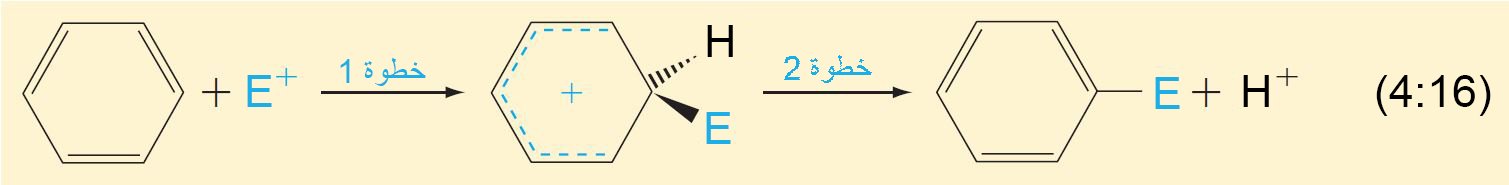
- يمكن تلخيص ميكانيكية جميع الاستبدالات الإلكتروفيلية العطرية ذات الخطوتين من خلال التفاعل التالي:
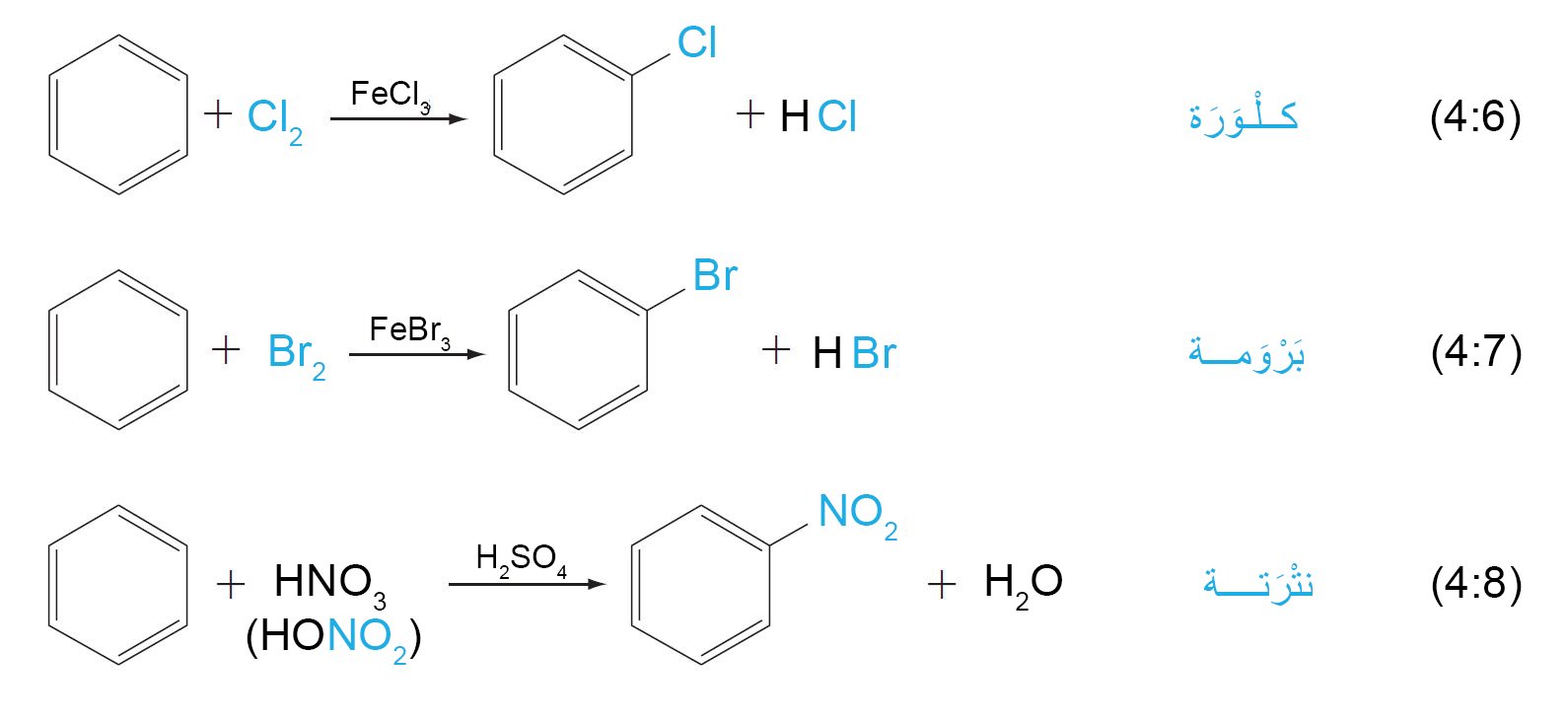
9. أ الهلجنة Halogenation
- يمكن ادخال الكلور أو البروم إلى الحلقة العطرية بوجود هاليد الحديد المقابل لها كعامل محفز (أي: Cl2 + FeCl3 أو Br2 + FeBr3 ) .
9. ب النترتة Nitration
- في تفاعلات نترتة الحلقات العطرية ، يقوم المحفز حمض الكبريتيك بمنح حمض النيتريك بروتونا و الذي بدورة يفقد الماء فيتشكل أيون النترونيوم (+NO2)، والذي هو إلكتروفيل قوي تتم مهاجمته من قبل الحلقة العطرية.

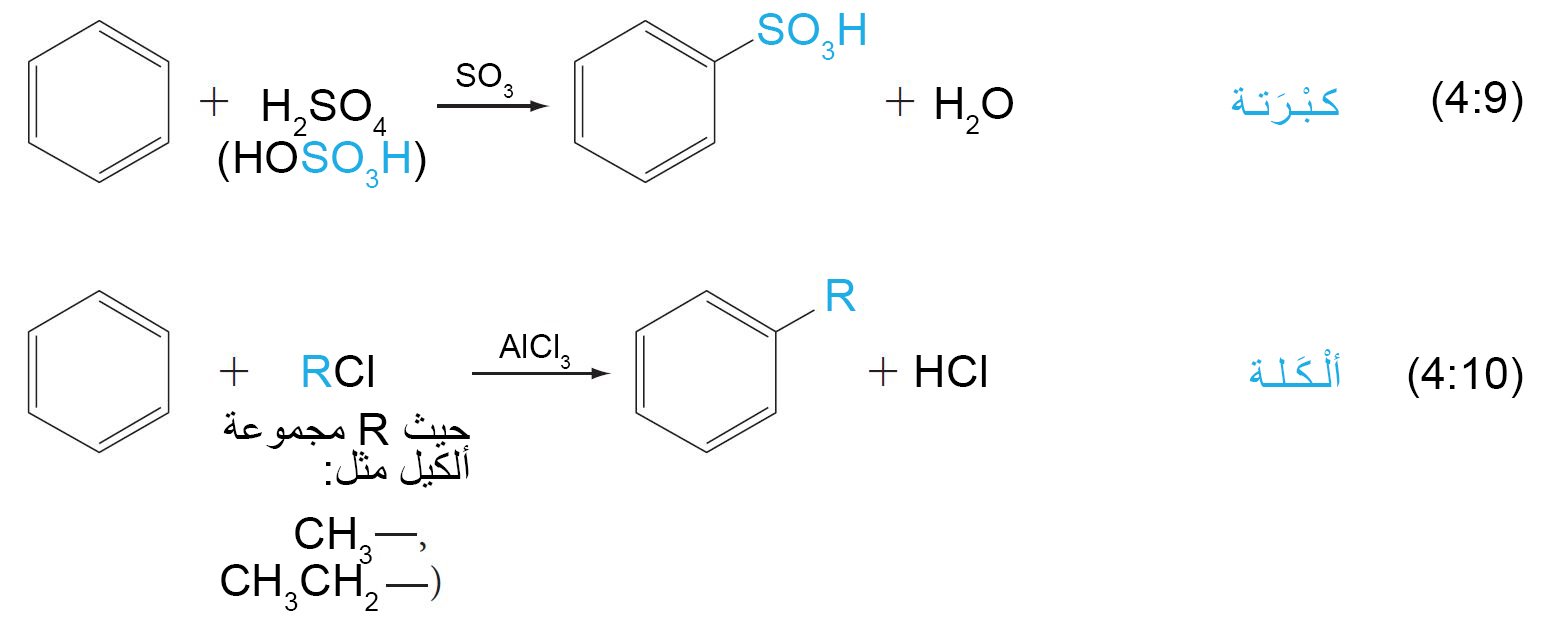
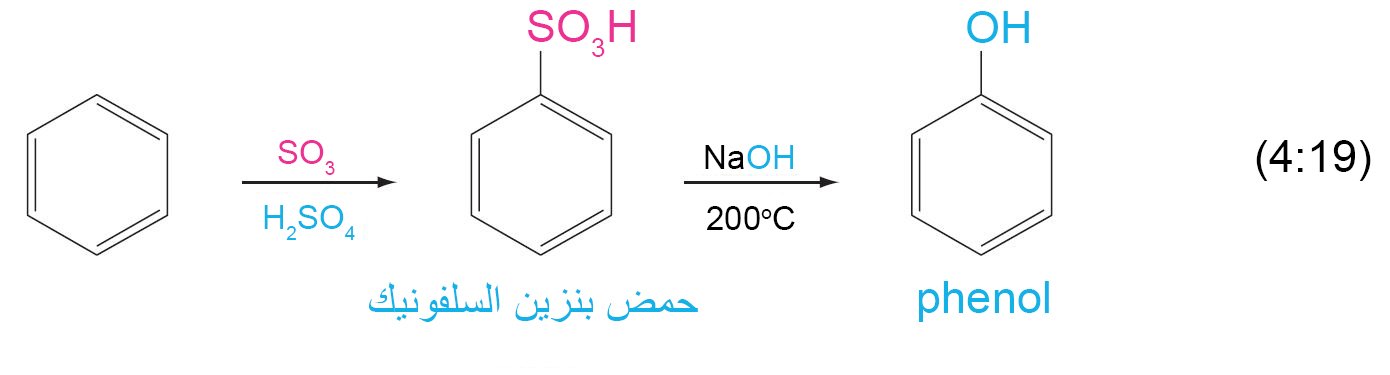
9.4. ج الكبرتة Sulfonation
- في تفاعلات كبرتة الحلقات العطرية ، فإننا نستخدم إما حمض الكبريتيك المركز أو المدخن ، اما الإلكتروفيل فقد يكون ثالث أكسيد الكبريت SO3 ، أو ثلاثي أكسيد الكبريت البروتوني +SO3H.

- ينتج عن تلك العملية حموض السلفونيك و هي حموض عضوية قوية ، و يمكن تحويلها إلى فينولات عن طريق تفاعلها مع قاعدة عند درجات الحرارة العالية.
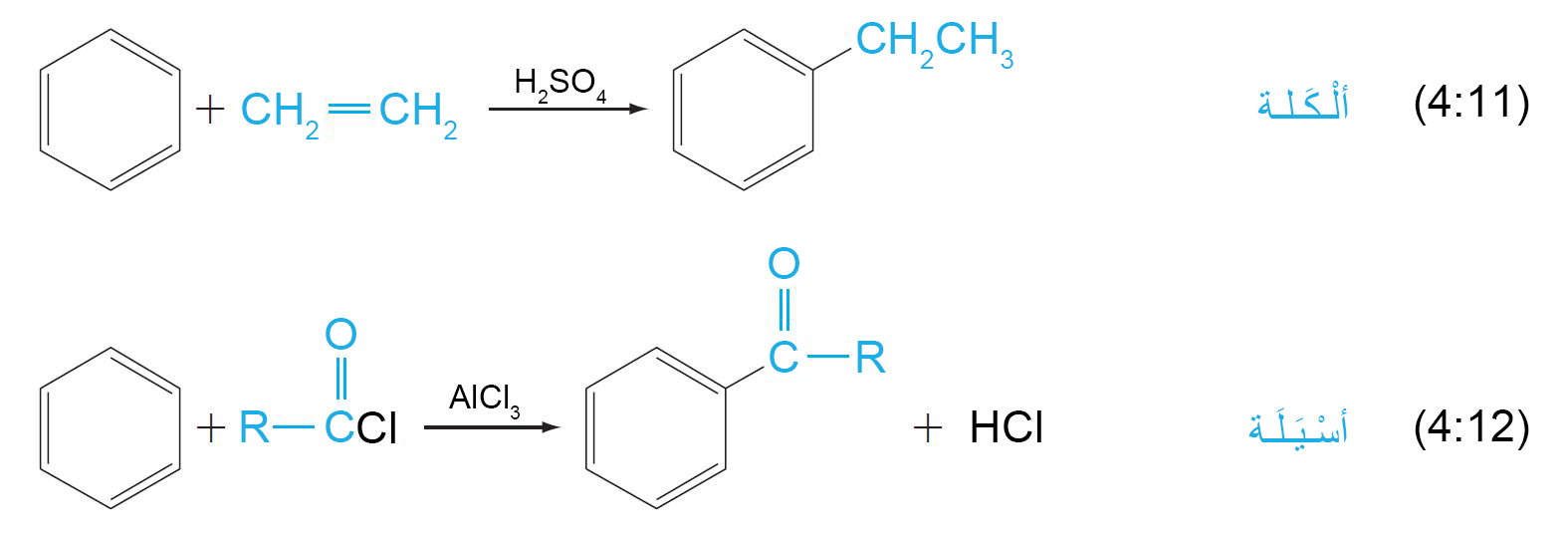
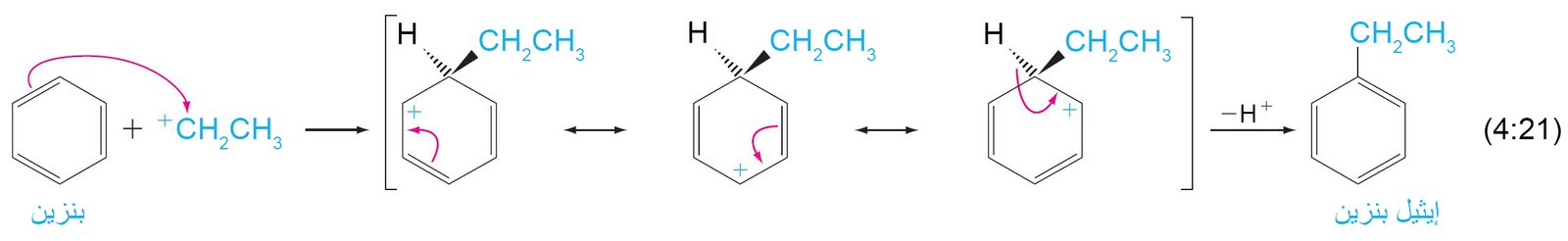
9. د الألكلة و الأسيلة Alkylation and Acylation
- تعرف عملية ألكلة المركبات العطرية أيضا باسم تفاعل فريديل-كرافت.
فالإلكتروفيل عبارة عن كربوكاتيون و الذي يمكن تحضيره إما بإزالة أيون الهاليد من ألكيل الهاليد بمساعدة حمض لويس كمادة محفزة (مثل: AlCl3)، أو عن طريق إضافة بروتون إلى ألكين.

- لا يمكن تطبيق ألكلة فريديل-كرافت على الحلقة العطرية الت تحتوي بالفعل على مجموعة حمض النيترو أو حمض السلفونيك ، لأن هذه المجموعات تشكل معقدات مع المحفز كلوريد الألومنيوم و تعمل على تعطيل فعاليته.
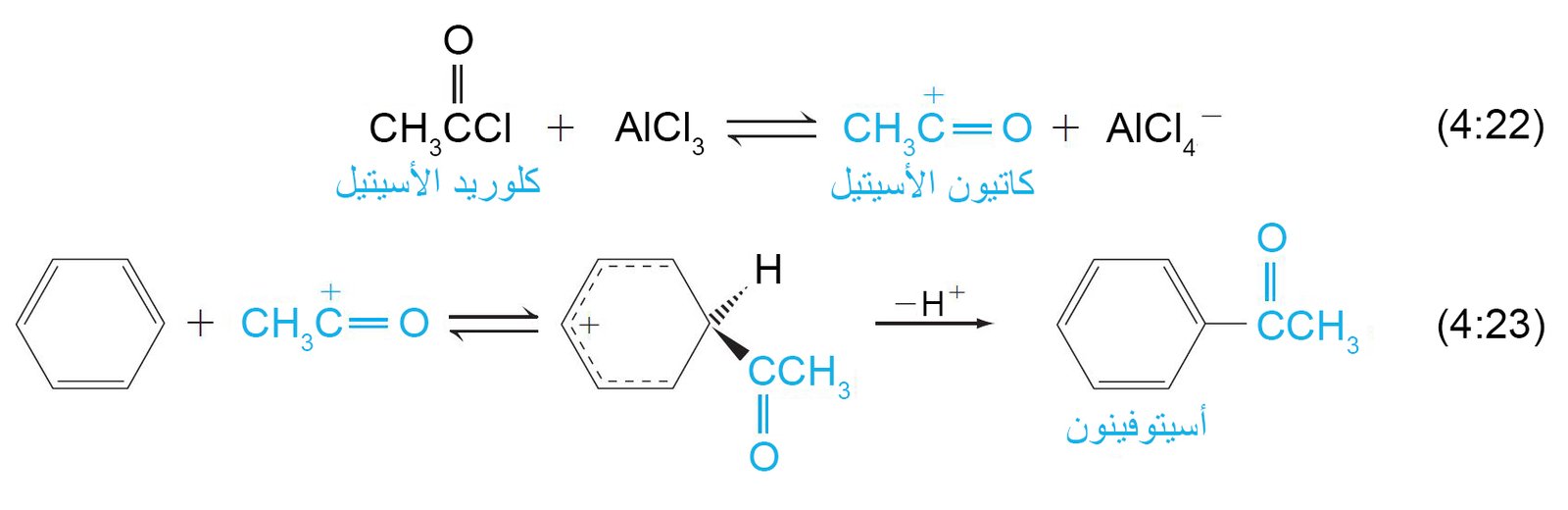
- في عملية أسيلة فريديل-كرافت ، فإن الإلكتروفيل هو عبارة عن كاتيون أسيل ينتج عن مشتق حمضي ، وعادة ما يكون هاليد الأسيل. يوفر هذا التفاعل مسارا عامًا مفيدًا لإنتاج الكيتونات العطرية.
10- المستبدلات المنشطة للحلقة و المعطلة لنشاط الحلقة Ring-activating and ring-deactivating substituents
- إذا كان معدل سرعة التفاعل يعتمد على قوة هجوم الإلكتروفيل على الحلقة العطرية، فإن المجموعة البديلة التي تمنح الإلكترونات للحقلة (مثل OH و CH3) سوف تسرع من سرعة التفاعل ، أما المجموعات البديلة التي تسحب الإلكترونات من الحلقة (مثل Cl و NO2) سوف تبطىء من سرعة التفاعل.
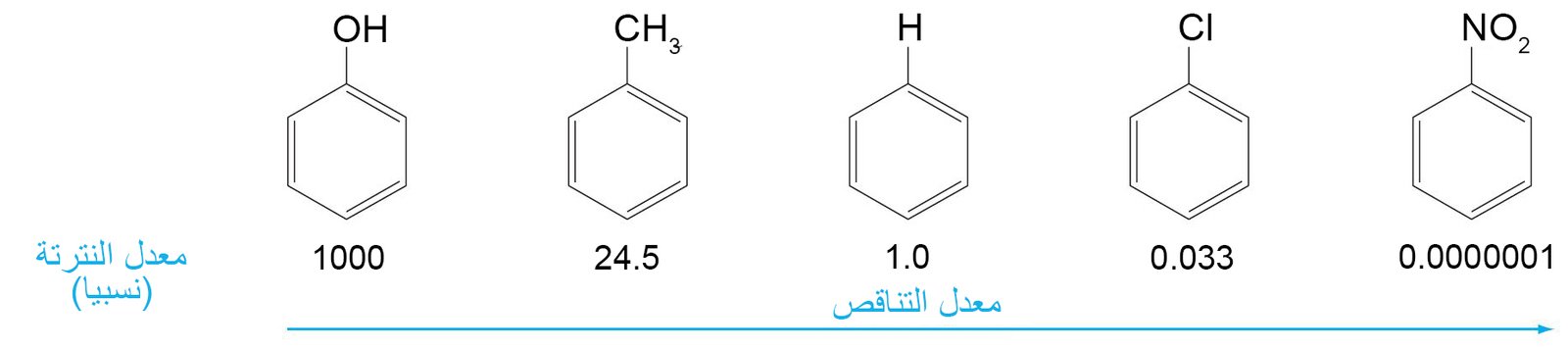
11- المجموعات الموجهة نحو أورثو و بارا و المجموعات الموجهة نحو ميتا Ortho,Para-Directing and Meta-Directing Groups
- إن الموجموعات البديلة الموجودة أصلا على الحلقة العطرية تحدد الموقع الذي سوف ترتبط به المجموعة البديلة الجديدة على نفس الحلقة. على سبيل المثال:
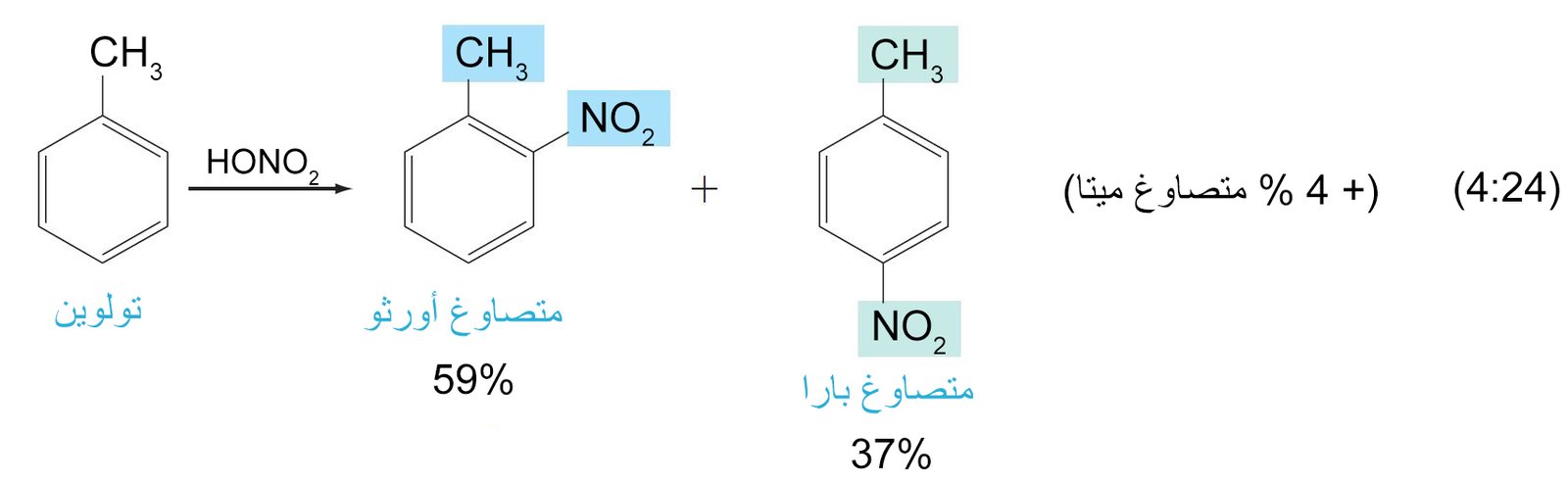
- تعمل المجموعات البديلة الموجهة نحو الموضع أورثو و بارا على حلقة البنزين على توجيه الإلكتروفيل الثاني (المجموعة البديلة الثانية) نحو موضع أورثو و بارا على الحلقة. بينما تعمل المجموعات البديلة الموجهة نحو الموضع ميتا على توجيه الإلكتروفيل الثاني نحو الموضع ميتا على الحلقة.
11.4. ا المجموعات الموجه نحو أورثو و بارا
- أي مجموعة مانحة للإلكترونات فإنها ستكون موجه للمجموعات البديلة الاخرى نحو موضعي أورثو و بارا .
جميع المجموعات التي تمتلك إلكترونات غير رابطة على الذرة المتصلة بالحلقة تكون مجهة نجو موضعي أورثو و بارا .
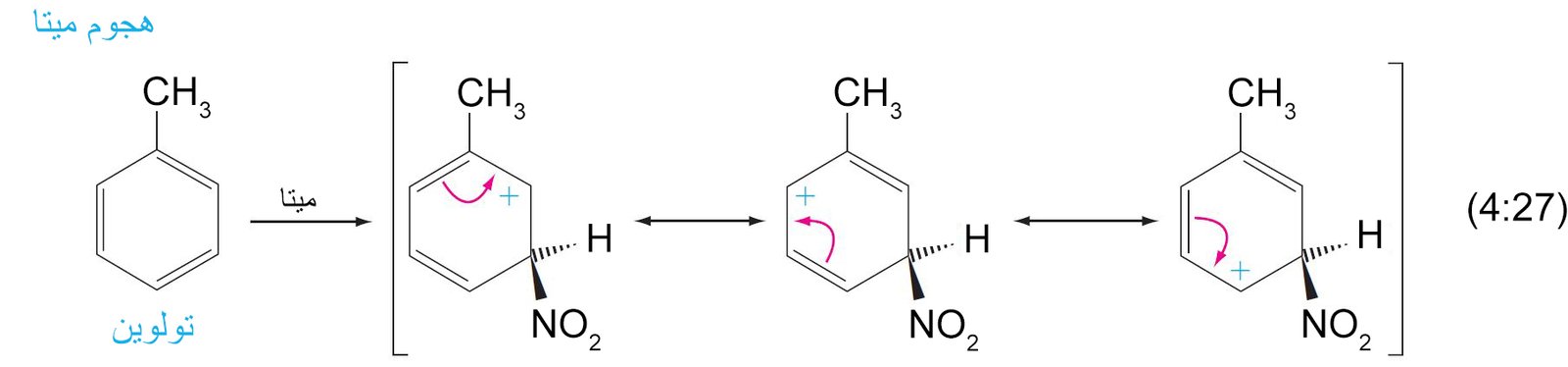
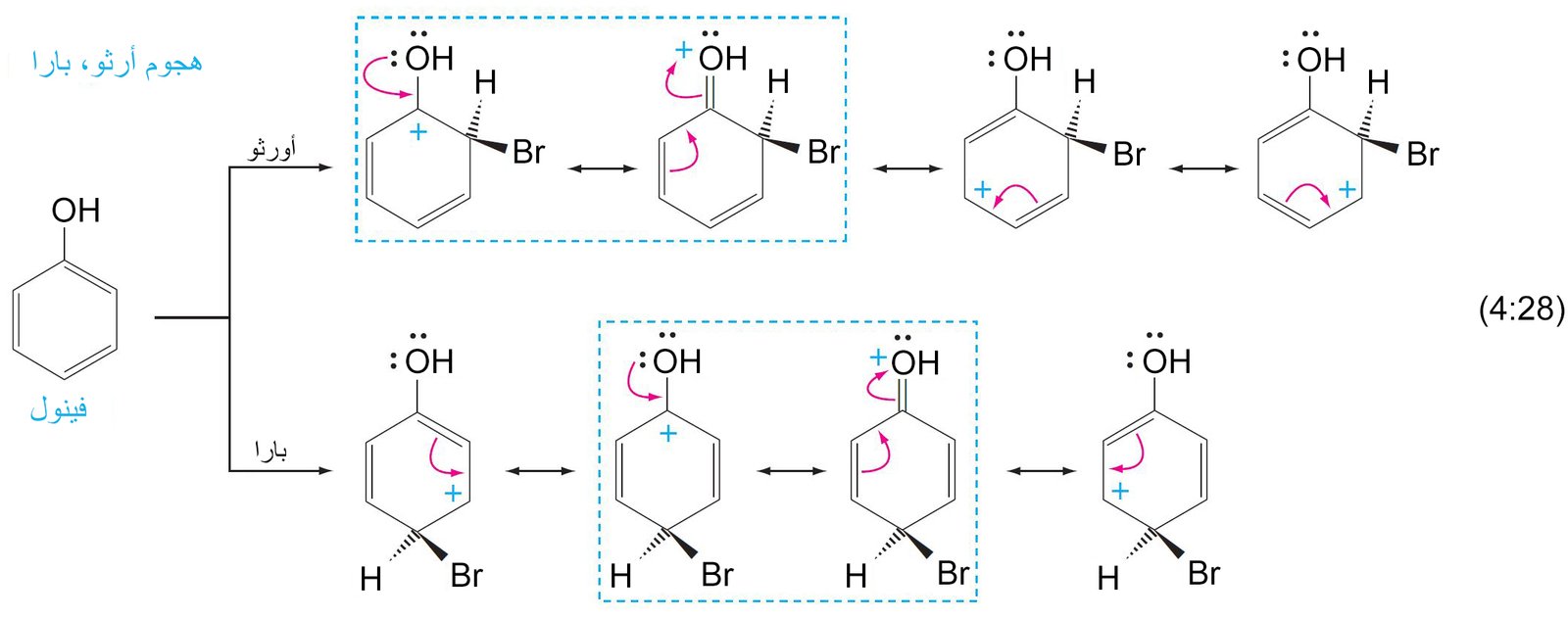

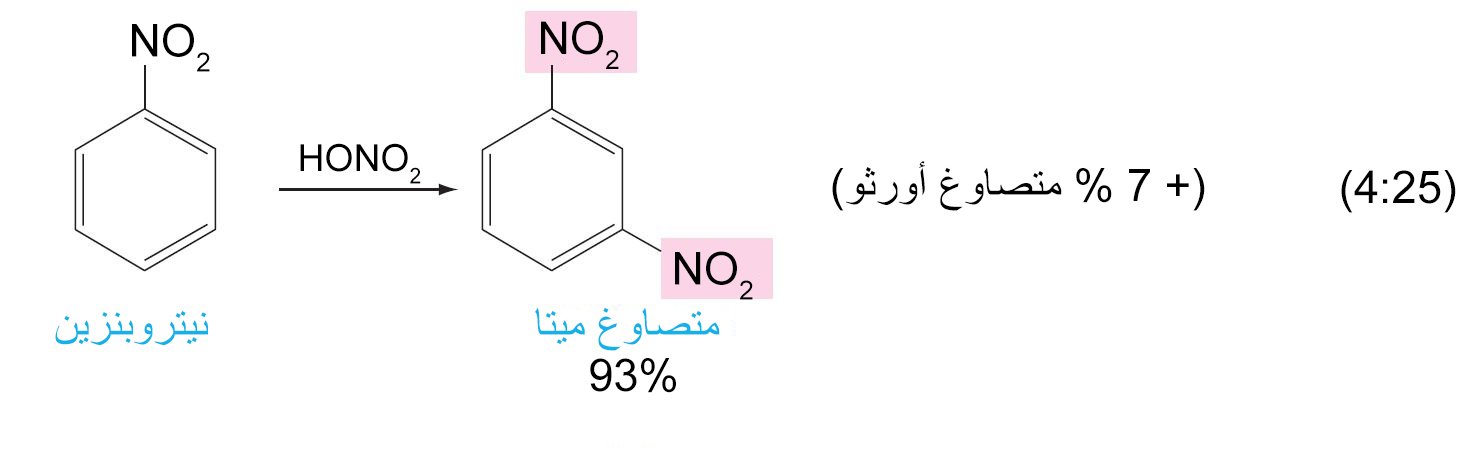
11. ب المجموعات الموجه نحو ميتا
- أي مجموعة ساحبة للإلكترونات فإنها ستكون موجه للمجموعات البديلة الاخرى نحو موضع ميتا .
- أي مجموعة يكون فيها ذرة تكون متصل مباشرة بحلقة البنزين و تحمل شحنة موجبة جزئية أو أنها طرف لرابطة متعددة لعنصر ذو كهروسالبية عالية فإنها ستكون موجه للمجموعات البديلة الاخرى نحو موضع ميتا .
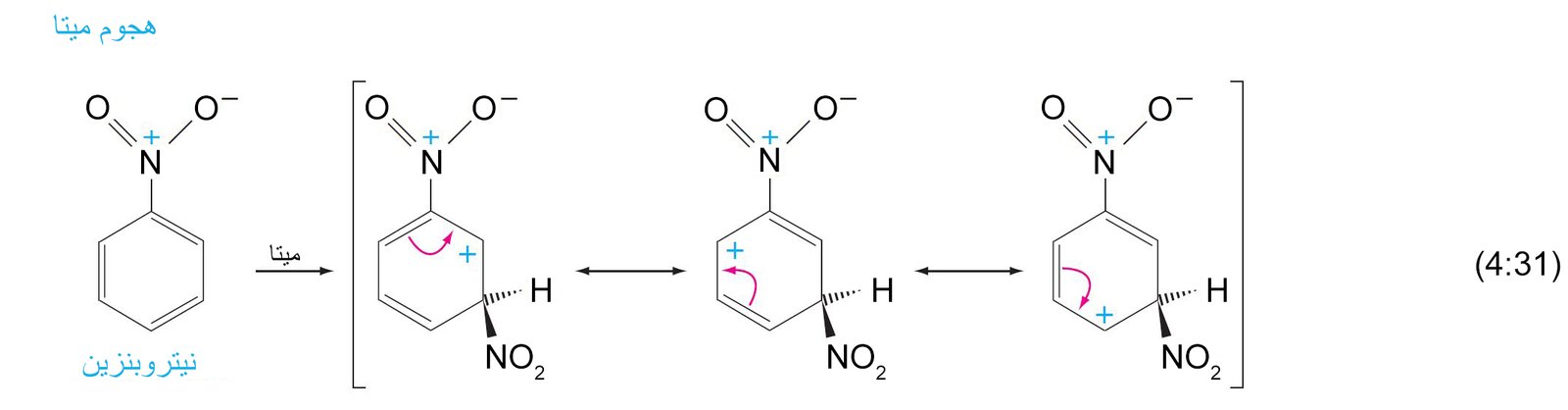

11. ج تأثير المجموعة البديلة على الفعالية (النشاط)
- تكون المجموعات البديلة (الموجودة أصلا على حلقة البنزين) نشطة إذا ما تم الاستبدال الإلكتروفيلي بصورة أسرع على الحلقة البنزين التي تحتويها مقارنة مع البنزين الذي لا يحتوي على أي مجموعات بديلة و العكس صحيح.
- جميع المجموعات الموجهة نحو طرف ميتا هي مجموعات غير نشطة للحلقة.
جميع المجموعات الموجهة نحو طرف أورثو أو بارا مجموعات نشطة للحلقة. - الهالوجينات (F ، Cl ، Br ، و I) ، هي غير نشطة للحلقة و لكنها تعمل على توجيه المجموعات البديلة نحو طرف أورثو و بارا.
12- أهمية التوجيه في الصناعة The Importance of Directing Effects in Synthesis
- من خلال التحكم بالمجموعات البديلة فإنه باستطاعتنا الحصول على المنتج المطلوب.

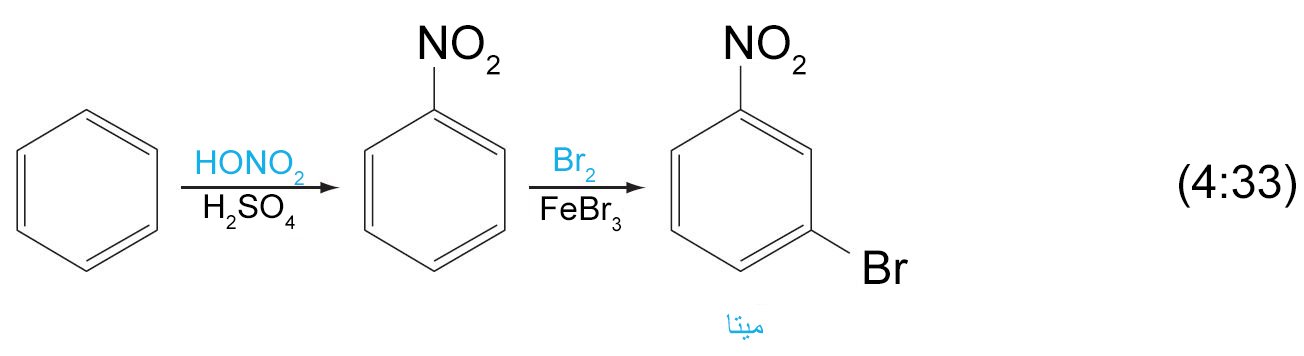
13 – الهيدروكربونات العطرية متعددة الحلقات Polycyclic Aromatic Hydrocarbons (PAHs)
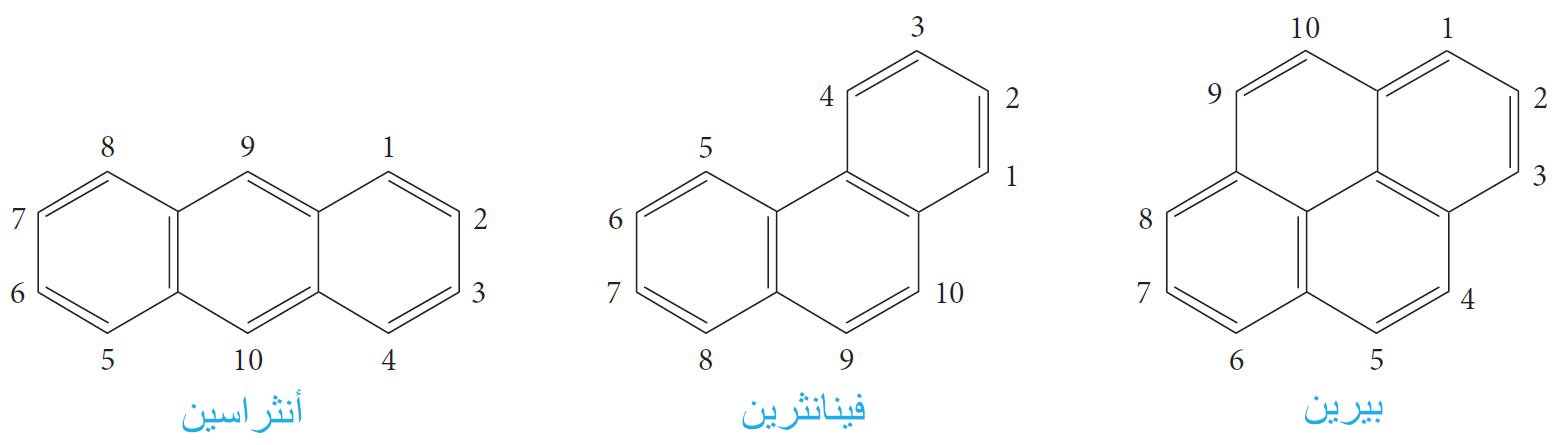
- هي مركبات تتكون من حلقات عطرية متعددة. و أبسط هذه المواد الكيميائية هي النفثالين ، الذي يحتوي على حلقتين عطريتين ، و أنثراسين وفينانثرين التي تتكون من ثلاث حلقات عطرية.
- توجد الهيدروكربونات العطرية متعددة الحلقات بشكل طبيعي في الفحم والنفط الخام والبنزين. كما يتم إنتاجها عند حرق الفحم والنفط والغاز والخشب والقمامة والتبغ.
- يُعدُّ النفثالين ، C10H8 ، أول مركب نقي أمكن الحصول عليها من قطران الفحم.
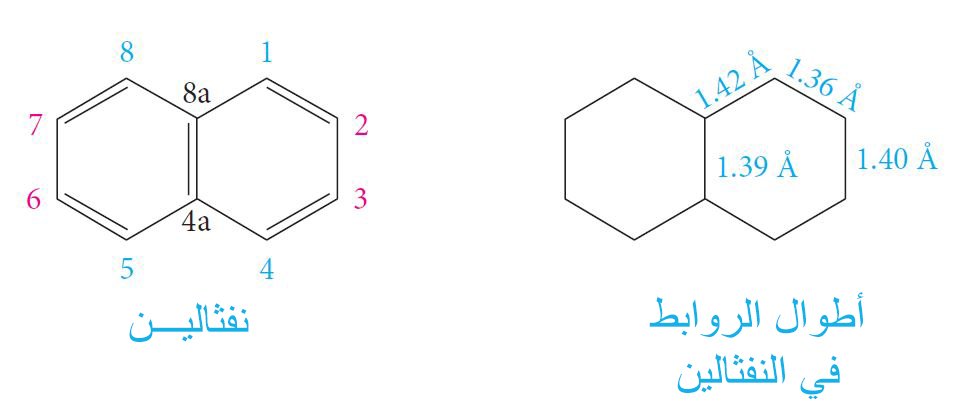
- إن أطوال الروابط في النفثالين ليست متساوية و لكنها جميعها ثه ضمن نطاق طول الرابطة في البنزين (1.39 أنجستروم).
- يُعدُّ النفثالين المركب الرئيس أو الأم للعديد من المركبات الهيدروكربونية العطرية ذات الحلقات المتعددة الملتصقة ببعضها البعض مثل الأنثراسن و الفينانثرين و البيرين.
بوسترات (لوحات) كيميائية بدقة عالية (أكثر من 25 لوحة) من تصميم الأستاذ أكرم أمير العلي
تطبيقات كيميائية من تصميم الأستاذ أكرم امير العلي متوفر للجوالات التي تعمل بنظام أندرويد android على سوق جوجل بلاي google play
1 – تطبيق ملصقات الجدول الدوري باللغة العربية : بطاقات تحتوي على معلومات شاملة و مختصرة في نفس الوقت كل عنصر على حدة (اللغة العربية).
https://play.google.com/store/apps/details?id=com.akramir2
2 – تطبيق ملصقات كيميائية: ملصقات بتصميم جميل جدا للكواشف و الأدلة و الزجاجيات المستخدمة في المختبر و كذلك ملصقات و بطاقات لخزانات حفظ المواد و الأدوات الزجاجية .
https://play.google.com/store/apps/details?id=com.akramir
3 – إذا كنت تواجه صعوبة في تحضير المحاليل الكيميائية الأكثر شيوعا في مختبرات الكيمياء و الاحياء، فهذا التطبيق سوف يساعدك كثيرا في تحضير المحاليل :
مقالات قد تفيدك :
 مصادر الكيمياء موقع لتعليم الكيمياء بصورة مبسطة
مصادر الكيمياء موقع لتعليم الكيمياء بصورة مبسطة