نظرية التصادم :
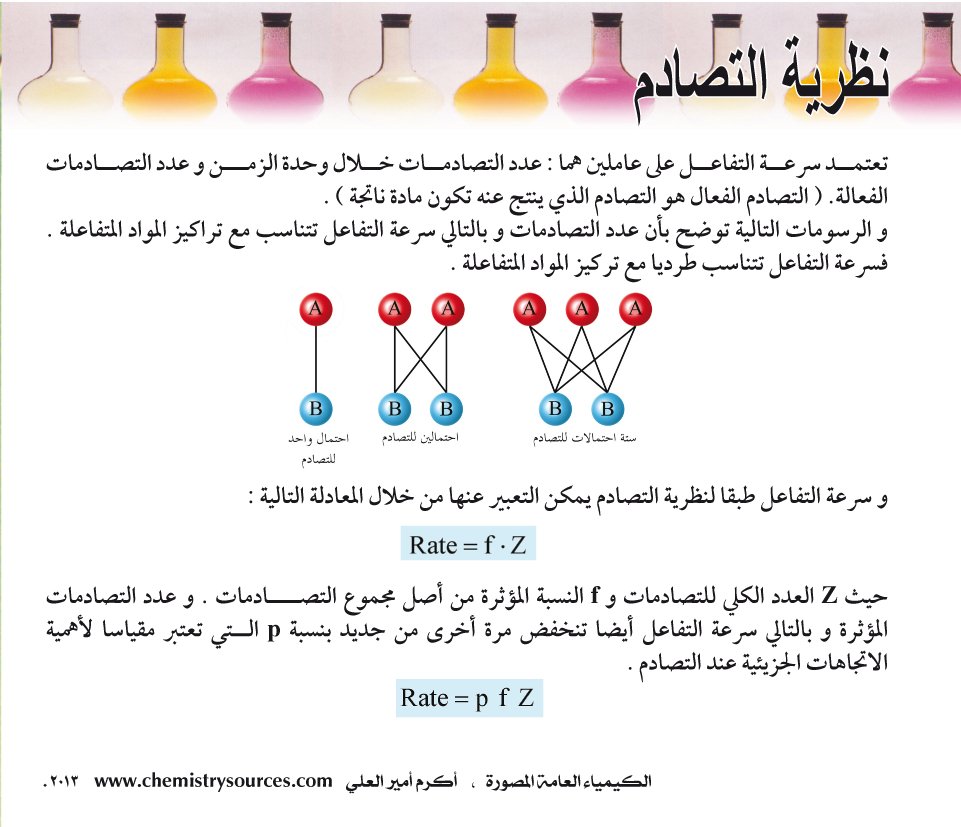
تعتمــد سرعــة التفاعــل على عاملين هما : عدد التصادمــات خــلال وحدة الزمـــن و عدد التصــادمات الفعالة. ( التصادم الفعال هو التصادم الذي ينتج عنه تكون مادة ناتجة ) .
و الرسومات التالية توضح بأن عدد التصادمات و بالتالي سرعة التفاعل تتناسب مع تراكيز المواد المتفاعلة . فسرعة التفاعل تتناسب طرديا مع تركيز المواد المتفاعلة .و سرعة التفاعل طبقا لنظرية التصادم يمكن التعبير عنها من خلال المعادلة التالية :
Rate = f . Z
حيث Z العدد الكلي للتصادمات و f النسبة المؤثرة من أصل مجموع التصــــادمات . و عدد التصادمات المؤثرة و بالتالي سرعة التفاعل أيضا تنخفض مرة أخرى من جديد بنسبة p الــتي تعتبر مقياسا لأهمية الاتجاهات الجزيئية عند التصادم .
Rate = p . f . Z
بوسترات (لوحات) كيميائية بدقة عالية (أكثر من 25 لوحة) من تصميم الأستاذ أكرم أمير العلي
تطبيقات كيميائية من تصميم الأستاذ أكرم امير العلي متوفر للجوالات التي تعمل بنظام أندرويد android على سوق جوجل بلاي google play
1 – تطبيق ملصقات الجدول الدوري باللغة العربية : بطاقات تحتوي على معلومات شاملة و مختصرة في نفس الوقت كل عنصر على حدة (اللغة العربية).
https://play.google.com/store/apps/details?id=com.akramir2
2 – تطبيق ملصقات كيميائية: ملصقات بتصميم جميل جدا للكواشف و الأدلة و الزجاجيات المستخدمة في المختبر و كذلك ملصقات و بطاقات لخزانات حفظ المواد و الأدوات الزجاجية .
https://play.google.com/store/apps/details?id=com.akramir
3 – إذا كنت تواجه صعوبة في تحضير المحاليل الكيميائية الأكثر شيوعا في مختبرات الكيمياء و الاحياء، فهذا التطبيق سوف يساعدك كثيرا في تحضير المحاليل :
مقالات قد تفيدك :
 مصادر الكيمياء موقع لتعليم الكيمياء بصورة مبسطة
مصادر الكيمياء موقع لتعليم الكيمياء بصورة مبسطة